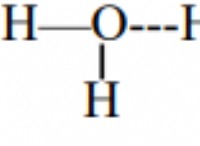열역학적 평형 :균형 상태
열역학적 평형은 시스템이 완전한 균형에있는 상태입니다 주변 환경과 함께. 이것은 다음을 포함하여 시간이 지남에 따라 시스템의 속성에 순 변화가 없음을 의미합니다.
* 온도 : 시스템과 주변 환경은 온도가 동일합니다.
* 압력 : 시스템과 주변은 동일한 압력 을가집니다.
* 화학 성분 : 시스템 내의 화학 물질의 양에는 순 변화가 없습니다.
* 볼륨 : 시스템의 볼륨은 일정하게 유지됩니다.
열역학적 평형에 대한 핵심 점 :
* 동적 평형 : 전반적인 변화는 없지만 연속 현미경 교환이있을 수 있습니다 시스템과 주변 환경 사이. 예를 들어, 닫힌 용기에서는 가스 분자가 끊임없이 움직이고 충돌하고 있지만 열이나 물질의 순 흐름은 없습니다.
* 분리 된 시스템 : 고립 된 시스템은 주변 환경에서 완전히 차단되므로 자연스럽게 평형에 도달합니다.
* 열린 시스템 : 개방형 시스템은 에너지를 교환하고 주변 환경과 관련이 있습니다. 개방 시스템에서 평형에 도달하려면 특별한 조건이 필요합니다.
* 평형 유형 :
* 열 평형 : 시스템과 주변 환경 사이의 동일한 온도.
* 기계적 평형 : 시스템과 주변 환경 사이의 동일한 압력.
* 화학 평형 : 화학 물질의 양의 순 변화는 없습니다.
열역학적 평형의 중요성 :
* 예측 가능성 : 평형을 이해하면 시스템과 프로세스의 동작을 예측할 수 있습니다.
* 효율성 : 많은 프로세스는 평형 또는 근처에서 작동하도록 설계되어 효율을 극대화합니다.
* 안정성 : 평형은 시스템이 자발적인 변화를 겪을 가능성이 가장 낮은 안정적인 상태를 나타냅니다.
열역학적 평형의 예 :
* 얼음 물 한 잔 : 얼음이 완전히 녹고 온도가 균일하면 시스템은 열 평형 상태입니다.
* 밀봉 된 가스 용기 : 가스의 압력과 온도는 시간이 지남에 따라 일정하게 유지됩니다.
참고 : 실제 시스템은 완벽한 평형을 거의 얻지 못한다는 것을 기억하는 것이 중요합니다. 그러나 열역학적 평형의 개념은 물리적 시스템의 행동을 이해하고 예측하기위한 강력한 프레임 워크를 제공합니다.