작동 방식은 다음과 같습니다.
1. 화학량 론 : 화학 방정식은 반응에 관여하는 반응물 및 생성물의 비율을 보여줍니다. 예를 들어, 반응에서 :
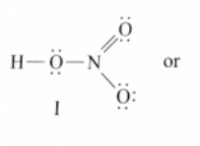
2H→ + o → 2H₂O
이는 2 몰의 수소 가스 (HAT)가 1 몰의 산소 가스 (OAT)와 반응하여 2 몰의 물 (HATE)을 생산한다는 것을 의미합니다.
2. 반응물 제한 : 제한 반응물은 먼저 완전히 소비되는 반응물이므로 반응을 중지합니다. 밀가루 2 컵과 설탕 1 컵이 필요한 레시피와 같습니다. 밀가루 1 컵 밖에 없다면 설탕이 많더라도 전체 레시피를 만들 수 없습니다. 밀가루는 제한 반응물입니다.
3. 제한 반응물 계산 : 제한 반응물을 찾으려면 다음을 수행해야합니다.
* 주어진 양의 각 반응물을 몰 질량을 사용하여 두더지로 변환하십시오.
* 균형 방정식으로부터 화학량 론적 계수를 사용하여 각 반응물로부터 형성 될 수있는 생성물의 두더지를 계산한다.
* 생성물의 최소량을 생산하는 반응물은 제한 반응물입니다.
4. 사용 된 금액 결정 : 제한 반응물을 알고 나면 각 반응물의 양을 계산할 수 있습니다. 제한 반응물은 완전히 소비되고, 다른 반응물은 화학량 론적 비율에 의해 결정된 비율로 사용될 것이다.
예 :
10 그램의 수소 가스 (HAT)와 20 그램의 산소 가스 (O₂) 반응이 있다고 가정 해 봅시다.
1. 두더지 :
* H₂ =10 g / 2 g / mol =5 몰의 두더지
* OJ =20 g / 32 g / mol =0.625 몰의 두더지
2. 화학량 론 : 방정식에서 우리는 다음을 알고 있습니다.
* 2 몰의 h of는 1 몰의 o ₂와 반응합니다.
3. 반응물 제한 :
* 우리가 5 몰의 h₂를 모두 사용하면 2.5 몰의 O₂ (5 몰 h₂ * 1 몰 / 2 몰 h₂ =2.5 몰)이 필요합니다. 우리는 0.625 몰의 O₂ 만 가지고 있으므로 O₂는 제한 반응물입니다.
4. 사용 된 양 :
* 모든 0.625 몰의 O₂가 사용됩니다.
* 사용 된 h₂의 양은 1.25 몰 (0.625 몰 O ₂ * 2 몰 h ₂ / 1 몰 O ₂ =1.25 몰 h₂)입니다.
요약하면, 제한 반응물은 화학 반응에 각 반응물의 양을 지시합니다.