주요 개념
* 에너지는 보존됩니다 : 폐쇄 시스템의 총 에너지량은 일정하게 유지됩니다. 그것은 한 형태에서 다른 형태로 변환 될 수 있지만 결코 생성되거나 파괴되지 않습니다.
* 발열 반응 : 일반적으로 열처럼 주변에 에너지를 방출합니다. 제품은 반응물보다 에너지가 적습니다. 불타는 불을 방출하는 열을 생각해보십시오.
* 흡열 반응 : 주변에서 에너지를 흡수하여 종종 열이 진행됩니다. 제품은 반응물보다 더 많은 에너지를 가지고 있습니다. 손에서 열을 흡수하는 차가운 팩을 생각해보십시오.
에너지에 무슨 일이 일어나는지 :
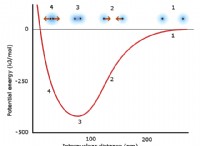
1. 채권 파괴 : 반응물의 원자들 사이의 결합을 깨뜨리려면 에너지가 필요하다. 이것을 본드 파괴 에너지 라고합니다 .
2. 새로운 채권 형성 : 제품에 새로운 채권이 형성되면 에너지가 방출됩니다. 이것을 본드 형성 에너지 라고합니다 .
에너지 변화 :
* 발열 반응 : 결합 형성 에너지는 결합 파괴 에너지보다 큽니다. 순 변화는 에너지의 방출입니다 (종종 열로).
* 흡열 반응 : 결합 파괴 에너지는 결합 형성 에너지보다 큽니다. 순 변화는 에너지의 흡수입니다.
에너지 변화에 영향을 미치는 요인 :
* 채권 유형 : 더 강한 결합은 형성 될 때 더 많은 에너지를 파괴하고 방출하기 위해 더 많은 에너지가 필요합니다.
* 채권 수 : 더 많은 채권은 일반적으로 더 많은 에너지가 관여한다는 것을 의미합니다.
* 반응 조건 : 온도, 압력 및 촉매의 존재는 모두 에너지 변화에 영향을 줄 수 있습니다.
예 :
산소 (O2)에서 메탄 (CH4)의 연소를 고려하십시오.
CH4 + 2O2 → CO2 + 2H2O + 열
* 채권 파괴 : 메탄과 산소의 결합을 파괴하려면 에너지가 필요합니다.
* 결합 형성 : 이산화탄소와 물로 새로운 결합이 형성되면 에너지가 방출됩니다.
* 순 변경 : 오래된 결합을 깨뜨리는 데 필요한 것보다 새로운 에너지가 방출되기 때문에 반응은 발열적이고 열을 방출합니다.
요약
화학 반응에는 에너지 변화가 포함됩니다. 에너지의 전반적인 변화는 결합을 파괴하는 데 필요한 에너지와 새로운 결합이 형성 될 때 방출되는 에너지의 차이에 의해 결정됩니다. 발열 반응은 에너지를 방출하는 반면 흡열 반응은 에너지를 흡수합니다.