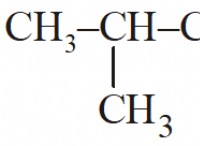일산화탄소 (CO)와 그 결합에 대해 명확히 할 수있는 것은 다음과 같습니다.
* 원자가 : 원자의 원자가는 결합 용량 또는 다른 원자와 형성 할 수있는 결합의 수를 나타냅니다. 탄소는 일반적으로 4의 원자가를 가지므로 4 개의 결합을 형성 할 수 있습니다.
* 일산화탄소 (CO) : 일산화탄소에서, 탄소는 산소와 2 개의 전자를 공유하여 삼중 결합을 형성한다. 이것은 탄소에 2 개의 비 결합 전자를 남깁니다.
* 공식 요금 : CO에서 탄소의 명백한 "원자가"를 이해하기 위해, 우리는 공식적인 청구를 살펴 봅니다. 분자에서 원자의 공식 전하는 다음과 같이 계산된다.
공식 전하 =(원자가 전자) - (비 결합 전자) - (1/2 결합 전자)
CO에서 탄소의 공식 전하는 4-2-3 =-1입니다. 이 부정적인 공식 전하는 탄소가 일반적인 원자가가 제안하는 것보다 더 많은 전자를 "공유"하고 있음을 시사합니다.
따라서 "잠재적 인 원자가"라는 용어는 표준이 아니지만 CO의 탄소는 트리플 본드로 인해 원자가가 낮은 것으로 보이지만 여전히 추가 결합에 참여할 수있는 2 개의 비 결합 전자가 있습니다. .
"원자가"는 형성된 결합의 수와 관련된 개념이며 CO와 같은 복잡한 분자에서 전자 분포 및 결합의 뉘앙스를 완전히 포착하지 않는다는 것을 기억하는 것이 중요합니다.