이유는 다음과 같습니다.
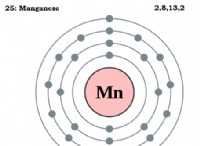
* Pauli 배제 원칙 : 이 원리는 원자의 두 전자가 동일한 4 개의 양자 수 세트를 가질 수 없다고 명시하고 있습니다.
* 양자 수 : 이 숫자는 원자 내의 전자의 특성을 설명합니다.
* 원칙 양자 번호 (n) : 전자의 에너지 수준을 설명합니다.
* 각 운동량 또는 방위각 양자 수 (L) : 궤도의 모양 (s, p, d, f)을 설명합니다.
* 자기 양자 수 (ml) : 공간에서의 궤도의 방향을 설명합니다.
* 스핀 양자 번호 (MS) : 전자의 고유 각 운동량을 설명하며, 이는 양자화되고 종종 전자 회전으로 시각화됩니다. 스핀 업 (+1/2) 또는 스핀 다운 (-1/2) 일 수 있습니다.
스핀 양자 수는 +1/2 또는 -1/2 일 수 있기 때문에 궤도는 반대쪽 스핀을 갖는 두 개의 전자 만 담을 수 있습니다.