주요 차이 - 망간 대 마그네슘
화학 요소는 원자의 핵에 동일한 수의 양성자를 갖는 원자를 나타내는 화학 종입니다. 지금까지 발견 된 모든 화학 요소는주기적인 요소 테이블에 배치됩니다. 이주기적인 원소 표는 핵에서 양성자 수의 오름차순 순서에 따라 화학 요소를 보여줍니다. 망간과 마그네슘은 그러한 화학 요소입니다. 망간은 원자에 25 개의 양성자가 있습니다. 마그네슘은 원자에 12 개의 양성자가 있습니다. 망간과 마그네슘은 화학적 및 물리적 특성이 다릅니다. 그들의 발생도 서로 다릅니다. 그러나 망간과 마그네슘의 주요 차이점은 망간의 용융점은 약 1246C이며, 이는 매우 높은 값이며 마그네슘의 용융점은 약 650C이며, 이는 망간의 값보다 상대적으로 낮은 값입니다.
주요 영역을 다루었습니다
1. 망간이란?
- 정의, 속성 및 반응
2. 마그네슘
- 정의, 속성 및 반응
3. 망간과 마그네슘의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :원자 번호, 전기 성, 마그네슘, 망간, 양성자
망간이란?
망간은 기호 mn에 의해 주어진 화학 요소입니다. 망간의 원자 수는 25 세이므로 핵에 25 개의 양성자로 구성됩니다. 망간의 원자 중량은 약 54.93 amu입니다. 망간의 전자 구성은 [ar] 3d4s로 제공됩니다. 따라서 망간은 주기율표의 d 블록에서 그룹 7에 속합니다. 망간은 D 블록 요소입니다. 전이 금속으로 간주됩니다.
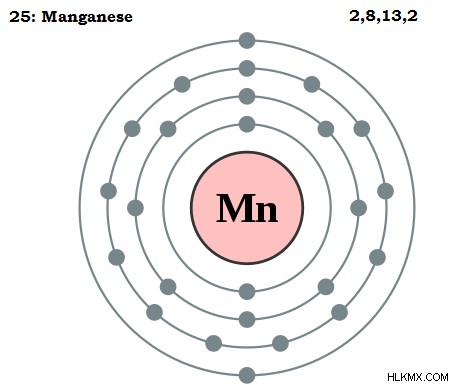
그림 1 :망간 원자 구조
표준 온도 및 압력 조건에서 망간은 고형 단계에 있습니다. 망간의 용융점은 약 1246C입니다. 매우 높은 가치입니다. 망간은 화합물의 여러 산화 상태에 존재할 수 있습니다. 산화 상태는 +7에서 -3까지 다양합니다. 망간의 전기성은 1.55로 주어진다. 망간의 원자 반경은 d 궤도의 존재로 인해 약 127시입니다.
망간은 상자성 화합물로 간주됩니다. 그것은 궤도에 짝을 이루지 않은 전자의 존재 때문입니다. 실온과 압력에서 망간은 매우 단단하고 부서지기 쉬운 금속입니다. 또한, 망간에는 몇 가지 자연 및 합성 동위 원소가 있습니다. 그러나 MN은 100% 안정 및 풍부 동위 원소이지만 다른 동위 원소는 매우 미량의 양으로 발견됩니다.
망간은 여러 가지 산화 상태를 가질 수 있으므로 다양한 산화 상태에서 다양한 유형의 고체 및 액체 화합물에서 찾을 수 있습니다. 가장 흔한 화합물 중 하나는 kmno 4 입니다 (칼륨 과망간산산염). 그것은 단단 할 때 어두운 바이올렛 색상이며, mno 4 를 형성하는 물에 쉽게 용해 될 수 있습니다. 이온. 이 솔루션은 또한 깊은 자주색을 가지고 있습니다. 여기서, 망간 원자는 +7 산화 상태에 있으며, 이는 산화 상태가 가장 높습니다.

그림 2 :칼륨 과망간산염 고체 화합물
망간은 강철 생산에 사용됩니다. 철강 생산에서 망간의 역할은 탈산 및 합금제 역할을하는 것입니다. 또한, 망간은 알루미늄 합금 생산에 사용됩니다. 그 외에도 망간은 실험실 규모 응용에 필요한 많은 화학 종에 유용합니다.
마그네슘
마그네슘은 기호 mg을 가진 화학 요소입니다. 요소의 주기율표의 그룹 2, 기간 3에 배치됩니다. 마그네슘의 원자 수는 12입니다. 즉, 마그네슘은 핵에 12 개의 양성자가 있음을 의미합니다. 실온 및 압력 조건에서 마그네슘은 고체입니다. 마그네슘의 전자 구성은 [ne] 3s입니다. 따라서 0 및 +2 산화 상태를 가질 수 있습니다.

그림 3 :마그네슘 결정
마그네슘의 녹는 점은 약 650c입니다. 마그네슘의 원자 질량은 24 amu로 주어진다. 주기율표의 S 블록에 있습니다. 같은 그룹의 마그네슘 및 기타 요소는 알칼리성 지구 금속으로 간주됩니다. 이는 그들이 형성하는 산화물에 기본 특성이 있기 때문입니다. 마그네슘의 전기성은 약 1.31입니다. 마그네슘의 원자 반경은 약 160 pm입니다.
마그네슘에는 3 개의 안정적인 동위 원소가 있습니다. 가장 풍부한 동위 원소는 mg입니다. 풍부함은 약 79%입니다. 그러나 마그네슘에는 방사성 동위 원소도 있습니다. 마그네슘은 실온에서 물과 반응 할 수 있습니다. 이 반응은 수산화 마그네슘을 형성하고 수소 가스 기포는이 반응 동안 물에서 진화된다. 마그네슘은 또한 많은 산과 반응하여 Mg 이온 및 수소 가스를 형성 할 수 있습니다. 마그네슘은 가연성이 매우 높습니다. 그것은 공기 중에 화상을 입을 수있어 매우 반짝이는 흰색 불꽃을 초래합니다.

그림 4 :공기 중 마그네슘
마그네슘은 주로 미네랄 퇴적물에서 찾을 수 있습니다. 이러한 미네랄은 백운석과 마그네이트입니다. 해수에는 상당한 양의 마그네슘 이온이 용해된다. 마그네슘은 특히 항공기 설계 및 자동차 설계에서 금속으로 넓은 응용 프로그램을 가지고 있습니다.
망간과 마그네슘의 차이
정의
망간 : 망간은 기호 Mn에 의해 제공되는 화학 요소입니다.
마그네슘 : 마그네슘은 기호 mg.
를 갖는 화학 요소입니다원자 번호
망간 : 망간의 원자 수는 25입니다.
마그네슘 : 마그네슘의 원자 수는 12입니다.
원자 중량
망간 : 망간의 원자 무게는 약 54 amu입니다.
마그네슘 : 마그네슘의 원자 중량은 약 24 amu입니다.
용융점
망간 : 망간의 용융점은 약 1246C입니다.
마그네슘 : 마그네슘의 용융점은 약 650C입니다.
원자 반경
망간 : 망간의 원자 반경은 오후 127시 정도입니다.
마그네슘 : 마그네슘의 원자 반경은 약 160 pm입니다.
주기 테이블의위치
망간 : 망간은주기적인 요소 테이블의 d 블록에 있습니다.
마그네슘 : 마그네슘은주기적인 요소 테이블의 S 블록에 있습니다.
전자 구성
망간 : 망간의 전자 구성은 [ar] 3d4s
입니다마그네슘 : 마그네슘의 전자 구성은 [ne] 3s
입니다전기 음성
망간 : 망간의 전기 음성은 약 1.55
입니다마그네슘 : 마그네슘의 전기 음성은 약 1.31
입니다산화 상태
망간 : 망간은 -3에서 +7의 산화 상태를 가질 수 있습니다.
마그네슘 : 마그네슘은 0 및 +2 산화 상태를 가질 수 있습니다.
결론
망간과 마그네슘은 지구의 지각에서 풍부하게 발견되는 화학 요소입니다. 둘 다 금속입니다. 두 이름은 약간 혼란 스럽지만 매우 뚜렷한 물리적 및 화학적 특성을 보여줍니다. 망간과 마그네슘의 주요 차이점은 망간의 용융점은 약 1246C이며, 마그네슘의 용융점은 약 650C이므로 망간보다 상대적으로 낮은 값입니다.
.