전자는 기본적인 음전하 e 의 기본 단위를 갖는 아 원자 입자입니다. . 전자는 입자 물리학의 표준 모델에서 가장 중요한 입자 중 하나이며 일반적인 바리닉 물질의 3 차 1 차 성분 (양성자 및 중성자) 중 하나입니다. 전자는 더 작은 부품이나 하위 구조를 갖지 않기 때문에 기본 입자로 간주됩니다.
전자의 가장 정확한 기록 측정은 0.000548579909067 AMU 의 질량을 제공합니다. , 이는 9.109382902843941771 × 10 kg 와 같습니다 . 이 양은 양성자의 질량의 1/1836과 동일합니다. 따라서, 전자는 정상 아 원자 입자 중 가장 방량입니다.
전자는 물질의 물리적 및 화학적 행동의 대부분을 직접 담당합니다. 화학적 결합은 전자 활성에 의해 결정되고, 분자 형상은 정전기 전위에 의해 결정되고, 색상은 전자에 의한 빛의 흡수에 의해 결정되며, 물질 (동결, 용융, 승화 등의 위상 거동은 분자간 전기 상호 작용에 의존한다.
전자의 특성
전자는 기본 입자로 간주되므로 적절한 부품이나 하위 구조가 없음을 의미합니다. 각 전자는 약 -1.602 × 10coulombs의 전하를 갖는다. 전자가 소유 한 전하는 가능한 가장 작은 음수 전하 단위이므로 그 값은 종종 초등 단위 이라고합니다. 요금. 이 전하는 정확히 동일하고 단일 양성자의 전하와 반대입니다.
충전 외에도 각 전자에는 spin 라는 속성이 있습니다. . 모든 전자의 고유 스핀은 1/2입니다. 전자의 스핀은 생성되는 자기 모멘트의 강도와 전자기장에서 전자가 어떻게 편향되는지를 결정합니다. 스핀은 때때로 고전적인 물리학에서 자체 축에서 회전하는 하전 된 바디가 자기장을 생성 할 때와 같이 각 운동량의 고전적 특성에 비유됩니다. 실제로,이 비유는 부적절합니다. 전자는 자체 축에서 회전하는 작은 구형 몸체가 아닙니다. 그것들은 포인트 입자이며 연속 값인 고전적인 몸체의 각 운동량과 달리 전자 스핀은 항상 이산 된 양자 값으로 제공됩니다. 스핀은 대신 양자 영역에 고유 한 전자의 본질적인 특성으로 간주되어야합니다.
모든 입자와 마찬가지로 전자는 파도와 같은 특성을 나타냅니다. 전자는 A wave 함수라는 수학적 함수로 표시 될 수 있습니다. (ψ)는 시간이 지남에 따라 전자의 위치와 운동량의 진화를 설명합니다. 파동 함수를 제곱하는 것은 측정 할 때 주어진 위치에서 전자를 찾을 가능성을 보여주는 확률 밀도를 제공합니다.
원자의 전자

전자에 대한 대부분의 전통적인 이해는 원자에서의 우리의 관찰에서 비롯됩니다. 전자는 정전기 인력으로 인한 양성자 및 중성자를 함유하는 핵에 결합한다. 일반적으로 중성 원자의 경우 동일한 양의 양성자 및 전자가 있습니다. 탄소의 정상적인 원자는 6 개의 양성자와 6 개의 전자를 갖는다. 양성자와 전자의 전하가 취소되고 전체 원자는 전기적으로 중립적입니다. 원자는 이온이되기 위해 전자를 얻거나 잃을 수 있습니다. 전자를 얻는 것은 음이온이라는 음으로 하전 된 이온을 생성합니다. 패배 전자는 양이온이라는 긍정적으로 하전 된 이온을 만듭니다.
일반적으로, 원자에 결합 된 전자는 특정 사전 정의 된 상태에서만 존재할 수있다. 이 상태를 원자 궤도라고합니다. 궤도는 사전 정의 된 모양을 가지고있어 존재하는 전자의 품질을 결정합니다. 가장 중요한 것은 각 궤도에는 명확한 양의 상태가 있으며 두 전자는 동시에 동일한 상태를 차지할 수 없습니다. 이것은 pauli 배제 원칙 로 알려져 있습니다 , 이것은 동일한 에너지로 동시에 동시에 두 개의 전자가 없을 수 없다고 말합니다. 두 개의 전자가 같은 상태에 존재하는 경우, 반대쪽 스핀 번호 +1/2 및 -1/2.
가 있어야합니다.원자는 전자를 제거하고 생성 된 이온을 유치하거나 전자를 공동으로 공유함으로써 화학적 결합을 형성합니다. 전자 방식으로 형성된 화합물은 이온 성이라고 불리며 후자의 방식으로 형성된 화합물은 공유라고합니다.

원자가 전자를 공유 할 때, 그들은 원자 궤도를 결합하여 분자 궤도를 생성함으로써 그렇게합니다. 원자 궤도가 결합 될 때, 분자 궤도는 두 원자 궤도의 조합 인 뚜렷한 모양을 취합니다. 연못의 파도가 새로운 파도 패턴을 방해하고 생성하는 방법과 마찬가지로 전자 궤도의 서있는 파도가 결합되어 새로운 안정적인 모양을 만듭니다.
원소의 결합 거동은 원자가 전자라고 불리는 가장 바깥 쪽 전자에 의해 결정됩니다. 대부분의 요소는 8 개의 전자의 전체 외부 쉘을 달성 할 때까지 화학적 결합을 형성합니다. 요소가 8 개의 전자로 외부 껍질을 채우는 경향을 옥트 규칙 이라고합니다. . 전기 음성화 규칙과 함께 옥트 규칙은 대부분의 주요 그룹 화합물의 조성을 예측하는 데 사용될 수 있습니다.
원소 및 화합물의 화학적 결합 거동을 결정하는 것 외에도, 전자는 여러 가지 물리적 특성을 결정합니다. 가장 분명히, 전자는 물체에 색상을주는 책임이 있습니다. 빛이 물체에 부딪히면 빛의 광자는 전자를 자극하여 더 높은 에너지 상태로 들어갑니다. 전자가 원래 에너지 수준으로 떨어지면 광자 (즉, 광파)를 뱉어냅니다. 관찰자의 눈에 반사되는 빛은 물체가 나타나는 색입니다. 정확한 전자 구성은 빛의 파장을 반사하고 물체의 색상을 결정합니다.
전자는 또한 극성과 반 데르 발스 힘의 형태로 물질 간의 분자간 상호 작용을 설명합니다. 극성 분자는 전자의 고르지 않은 분포로 인해 부분 전하가 있습니다. 분자 사이의 극성 상호 작용은 동결 지점, 용융점, 끓는점, 비열 용량 및 열역학적 흡수 속도에 영향을 미칩니다.
마지막으로, 전자는 또한 분자 형상을 결정합니다. 공유 결합 화합물에서, 전자는 자체 사이의 전위를 최소화하기 위해 전자가 확산 될 것이다. 결과적으로 전자가 화합물에 어떻게 배열되는지 아는 경우, 해당 화합물의 분자가 어떤 기하학적 형태인지 예측할 수 있습니다. 전자 배열로부터 기하학적 형상을 예측하는 데 중점을 둔 화학 분야를 VESPR 이론이라고합니다.
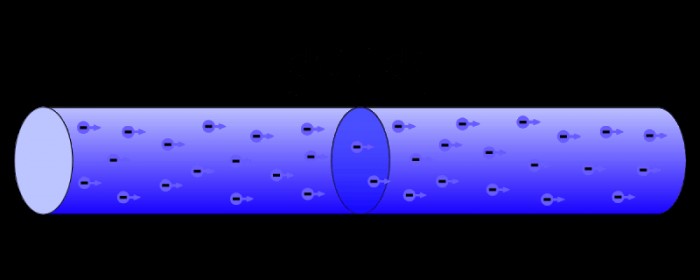
전자는 또한 전기 현상을 담당하는 본체입니다. 전류는 물질을 통한 음으로 하전 된 전자의 움직임으로 구성됩니다. 하전 입자의 움직임은 작업을 생성하므로 전기 에너지를 활용하여 물리적 작업을 수행 할 수 있습니다.
전자의 역사
인간은 적어도 고대 그리스인 이후 전기 현상에 대해 알고 있습니다. Pliny the Elder는 가열 된 호박색 조각이 작은 톱밥 조각을 끌어 들이고 철의 파편을 격퇴 할 것이라고 보여주었습니다. 우리는 지난 300 년 정도에 불과 전기 힘의 원인에 대한 정교한 이론적 이해를 개발 한 것입니다.
1700 년대에 정전기에 대한 실험으로 과학자들은 전기력이 유리체와 수지라고 불리는 두 가지 유형의 반대 유체로 인해 발생했으며, 이는 마찰로 분리 될 수 있으며 서로를 끌어들일 수 있다고 생각했습니다. 이시기에 벤자민 프랭클린 (Benjamin Franklin)은 두 유체가 실제로 양성 초과 (+) 또는 음의 적자 ( -)를 갖는 단일 유체라고 제안하여 현대의 긍정적 및 음전하에 대한 우리의 현대 표기법을 제공한다고 제안했다.
.1800 년대에 과학자들은 단위 전하가있는 아 원자 입자로 구성된 원자의 그림을 받아들이 기 시작했습니다. 1874 년 아일랜드 물리학 자 조지 스토니 (George Stoney)는 기본적인 전하 전하의 기본 단위, 이론적 입자가 처음“전기”와 나중에“전자”라고 불렀던 일부 입자가 존재한다고 이론화했다. 당시 Stoney는 그러한 입자의 존재에 대한 명확한 증거를 가지고 있지 않았지만 물체간에 전기가 어떻게 수행되는지에 따라 그것을 가정했습니다.
오늘날 우리가 이해 한 전자는 영국 물리학 자 J.J Thompson에 의해 발견되고 확인되었습니다. 1897 년에 톰슨은 음극 광선이 질량에 비해 매우 큰 전하를 갖는 음으로 하전 된 입자로 구성되어 있음을 입증했다. Thompson은 원래 입자를“소체”라고 부르기를 원했지만 다른 과학자들은 Stoney가 9 년 전에 제안한“Electron”이라는 이름을 선호했습니다. 1911 년 Robert Millikan은 단일 전자의 정확한 전하를 정확하게 측정 한 그의 유명한 석유 드롭 실험 결과를 발표했습니다.
1913 년, 덴마크 물리학 자 닐스 보어 (Niels Bohr)는 전자가 명확한 에너지 상태의 원자 주위에 존재하여 전자의 첫 번째 양자 기계적 그림을 야기한다고 이론화했다. 1924 년 루이 드 브로 글리 (Louis de Broglie)는 박사 학위 논문을 출판했으며, 이로 인해 전자가 포함 된 모든 입자가 이중 파동 입자 특성을 가졌다는 가설을 세웠다. 이 실현으로 인해 1926 년 Erwin Schrödinger는 전자의 파도와 같은 동작을 설명하는 수학적 함수 인 파동 함수의 수학적 개념을 개발하게되었습니다. Schrödinger의 파도 기능 방정식에 대한 추가 연구는 전자의 항 입자 인 양전자를 발견하게되었습니다. 전자에 대한 현재의 이해는 현대 양자 전기 역학에 캡슐화되며, 물리학 자 Richard Feynman이 개척 한 현장.