다음은 고장입니다.
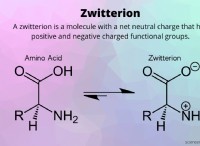
기본 아미노산 구조 :
모든 아미노산은 일반적인 기본 구조를 공유합니다.
* 중앙 탄소 원자 : 이것은 알파 탄소이며 다음과 같이 결합됩니다.
* 아미노 그룹 (NH2) : 두 개의 수소 원자가있는 질소 원자.
* 카르 복실 그룹 (COOH) : 산소 원자에 이중 결합 된 탄소 원자 및 하이드 록실 그룹 (OH)에 단일 결합.
* 수소 원자 (H) : 단일 수소 원자.
* 사이드 체인 (R-Group) : 이것은 하나의 아미노산을 다른 아미노산과 구별하는 가변 부분입니다.
측쇄의 변형 (R- 그룹) :
R- 그룹은 각 아미노산의 고유 한 특성을 결정하는 것입니다. 그들은 다음과 같습니다.
* 크기 : 일부는 작고 단순하고 (글리신처럼), 다른 일부는 크고 복잡합니다 (Tryptophan과 같은).
* 충전 : R- 그룹은 양전하 (기본), 음전 하전 (산성) 또는 중립적 일 수 있습니다.
* 극성 : R- 그룹은 극성 (친수성, 물에 끌리는) 또는 비극성 (물에 의해 반발 된 소수성) 일 수 있습니다.
* 화학 반응성 : 일부 R- 그룹은 다른 그룹보다 반응성이 높기 때문에 단백질 내에서 특정 화학 반응에 참여할 수 있습니다.
아미노산 변화의 예 :
* 글리신 (Gly, G) : R- 그룹으로서 수소 원자 만 갖는 가장 간단한 아미노산.
* Alanine (ala, a) : R- 그룹으로서 메틸기 (CH3)를 가지고있어 비극성으로 만듭니다.
* 아스파르트산 (ASP, D) : 카르 복실 그룹 (COOH)을 R- 그룹으로, 음전하를줍니다.
* 라이신 (lys, k) : 긴 체인에 아미노기 (NH2)가있어 긍정적으로 하전됩니다.
측쇄 변형의 결과 :
R- 그룹의 다양성은 단백질 기능에 필수적입니다.
* 단백질의 3D 구조 : R- 그룹 간의 상호 작용은 단백질이 어떻게 접히고 독특한 형태를 취하는 방식에 영향을 미칩니다.
* 는 단백질 기능에 영향을 미칩니다 : R- 그룹은 단백질이 기질, 효소 및 기타 단백질을 포함한 다른 분자와 상호 작용하는 방법을 결정합니다.
* 다양한 단백질 패밀리를 생성합니다. 상이한 서열의 상이한 아미노산을 조합함으로써, 독특한 구조 및 기능을 갖는 광범위한 배열의 단백질을 생성 할 수있다.
본질적으로, 아미노산 구조, 특히 측쇄에서의 변화는 단백질 다양성의 기초이며 단백질이 살아있는 유기체에서 수행하는 놀라운 기능 범위이다.