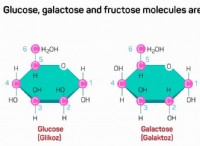
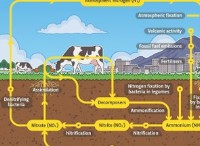
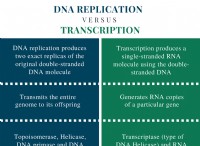
이유는 다음과 같습니다.
* 전자 친화력 전자가 기체 상태의 중성 원자에 첨가 될 때 에너지 변화의 척도이다.
* 금속은 일반적으로 전자 친화도가 낮습니다 이들은 양의 이온 (양이온)을 형성하기 위해 전자를 잃는 경향이 있기 때문이다. 이것은 느슨하게 고정 된 외부 전자 때문입니다.
* 비금속은 일반적으로 더 높은 전자 친화도를 갖는다 이들은 음이온 (음이온)을 형성하기 위해 전자를 얻는 경향이 있기 때문이다. 그들은 추가 전자가 외부 껍질을 채울 수있는 강력한 매력을 가지고 있습니다.
그러나 예외가 있습니다.
* 일부 금속은 일부 비금속보다 더 높은 전자 친화력을 가질 수 있습니다. 예를 들어, 금 (AU)은 브롬 (BR)보다 전자 친화력이 높습니다. 이는 전자 친화력에 영향을 미치는 요인이 복잡하고 원자 크기, 전자 쉘 수 및 효과적인 핵 전하와 같은 여러 가지에 의존하기 때문입니다.
* 전자 친화력 값은 동일한 그룹 또는 기간 내에서 크게 다를 수 있습니다. 예를 들어, 할로겐 (그룹 17) 내에서, 불소 (F)는 가장 작고 가장 전기 음성 할로겐 임에도 불구하고 전자 친화력이 가장 높다.
따라서 비금속이 일반적으로 금속보다 전자 친화력이 높지만 예외가 있다고 말하는 것이 더 정확합니다.