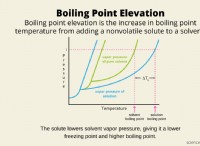
* 분해 반응은 단 하나의 반응물 만 있습니다. 분해 반응은 단일 물질이 둘 이상의 단순한 물질로 분해됩니다. 제한 할 "반응물"은 없습니다.
* 제품의 양은 초기 반응물의 양에 의해 결정됩니다. 분해 반응에서, 형성된 생성물의 양은 반응물의 초기 양에 직접적으로 의존한다.
* "이론적 수율"은 다르게 적용됩니다. 제한 반응물에 대해 이야기하는 대신, 우리는 초기 반응물의 완전한 분해에 기초하여 생성물의 "이론적 수율"을 고려한다.
예 :
100 그램의 탄산염 (CACO3)을 산화 칼슘 (CAO)과 이산화탄소 (CO2)로 분해한다고 가정 해 봅시다.
* 제한 반응물 없음 : 분해 반응은 CACO3 만 포함한다.
* 이론적 수율 : 100 그램의 CACO3의 완전한 분해에 기초하여 CAO 및 CO2의 이론적 수율을 계산할 수 있습니다.
요약 : 분해 반응은 제한 및 과도한 반응물의 개념을 포함하지 않습니다. 생성물의 양은 분해를받는 단일 반응물의 초기 양에 의해 결정된다. 우리는 이론적 수율에 중점을 둡니다. 이는 형성 될 수있는 최대 제품의 양입니다.