리튬 금속 (Li)
* 금속 결합 : 리튬은 금속이며, 금속은 금속 결합이라는 독특한 유형의 결합을 가지고 있습니다. 이러한 유형의 결합에서, 리튬 원자의 가장 바깥 전자는 느슨하게 고정되어 있으며 금속 격자 전체에 자유롭게 움직일 수있다.
* 유리 전자 : 이 자유롭게 움직이는 전자는 전하 담체 역할을합니다. 전압이 금속에 가해지면이 전자는 쉽게 흐르면 전류가 생성 될 수 있습니다.
* 좋은 지휘자 : 이 전자의 자유로운 움직임은 리튬 금속이 우수한 전기 도체로 만듭니다.
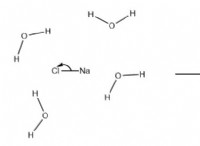
클로라이드 리튬 (LICL)
* 이온 결합 : 리튬 클로라이드는 이온 성 화합물입니다. 이온 성 화합물에서, 전자는 자유롭게 공유되지 않고 하나의 원자에서 다른 원자로 전달되며, 양으로 하전 된 이온 (양이온) 및 음이온 (음이온)을 생성한다.
* 고정 된 이온 : 이들 이온은 단단한 결정 격자 구조로 함께 고정된다. 그들은 화합물 전체에 자유롭게 움직일 수 없습니다.
* 가난한 도체 (고체) : 고체 상태에서, 이온이 고정되어 있기 때문에 염화 리튬 리튬은 전기를 전도하지 않습니다.
* 좋은 지휘자 (용융 또는 용해) : 그러나 염화 리튬이 녹거나 물에 용해되면 이온이 자유롭게 움직일 수 있습니다. 이것은 화합물 이이 상태에서 전기를 전도 할 수있게한다.
키 테이크 아웃 : 전기 전도도의 차이는 재료 내 결합의 기본 특성으로 요약됩니다. 금속은 전류를 쉽게 운반하는 유리 전자를 가지고 있으며, 이온 성 화합물은 고체 상태에서 쉽게 움직일 수없는 고정 된 이온을 가지고 있습니다.