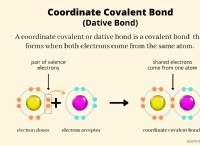
* 약산 : 약산은 용액에서 부분적으로 이온화되며, 이는 모든 양성자 (H+)를 기증하여 하이드로 늄 이온 (H3O+)을 형성하지 않습니다.
* 양성자 얻기 : 이것은 실제로 약산이 Brønsted-lowry 산-염기 이론에서 * 염기 * 역할을한다는 것을 의미합니다. 베이스는 양성자 (H+)를 받아들입니다.
여기에 중요한 요점이 있습니다 :
약산은 완전히 기증하지 않기 때문에 약합니다 그들의 양성자. 그러나 특정 상황에서는 기지로 작용할 수 있습니다 양성자가되어 양성자가되면 * 수용 *. 이것은 특정 반응과 존재하는 다른 종에 따라 다릅니다.
예 :
약산 인 아세트산 (CH3COOH)을 고려하십시오. 양성자를 물에 기증하여 아세테이트 이온 (CH3cOO-) 및 히드로 늄 이온 (H3O+)을 형성 할 수 있습니다.
CH3COOH + H2O ⇌ CH3COO- + H3O +
그러나, 우리가 용액에 강한 염산 (HCl)과 같은 강산과 같은 강산을 첨가하면, 아세테이트 이온은 염기로서 작용하고 HCl로부터 양성자를 수용하여 아세트산을 다시 형성 할 수있다.
CH3COO- + HCL ⇌ CH3COOH + CL-
요약 :
* 약산은 주로 불완전한 양성자 기증으로 특징 지어집니다 솔루션에서.
* 그러나 그들은 기지 역할을하고 양성자를 얻을 수 있습니다 . 특정 조건 하에서.
* 양성자를 얻는 약산의 능력은 특정 화학 환경에 달려 있습니다.