단일 대체 반응 또는 단일 변위 반응의 정의를 얻으십시오. 단일 대체 반응의 예를 들어보고 금속 반응성 시리즈를 사용하여 반응이 발생하는지 여부와 생성물을 예측하는 방법을 배우십시오.
단일 교체 반응 정의
단일 대체 반응 한 요소가 화합물에서 다른 요소를 대체하는 화학 반응입니다. 단일 변위 반응 라고도합니다 . 단일 대체 반응 화학 방정식의 일반적인 형태는 다음과 같습니다.
A + BC → B + AC
단일 대체 반응은 A가 B보다 반응성이 높거나 제품 AC가 BC보다 안정적 일 때 발생합니다. A와 B는 2 개의 금속 (수소 포함; C는 음이온)이거나 그렇지 않으면 2 개의 할로겐 (C는 양이온) 일 수 있습니다. BC와 AC가 수성 용액에 있으면 C는 관중 이온 역할을합니다.
단일 대체 반응 예
단일 교체 반응에 대한 두 가지 시나리오가 있습니다. 한 형태의 반응에서, 한 양이온은 다른 양이온을 대체합니다. 반응의 다른 형태에서는 한 음이온이 다른 음이온을 대체합니다.
양이온 교체 예
일반적으로 양이온은 금속이지만 그럴 필요는 없습니다. 양이온과 관련된 단일 대체 반응의 예는 다음과 같습니다.
- Zn (S) + 2 HCL (aq) → Zncl 2 (aq) + H 2 (g)
- 2 k + 2h 2 O → 2 KOH + H 2 (우리가 물을 hoh로 쓰지 않기 때문에 음이온이 어떻게 다르게 쓰여지는지 참조)
- cu + 2 agno 3 → 2 Ag + Cu (no 3 )
2 - Ca + 2 H 2 o → Ca (OH)
2 + h 2
그러나, 요소 형태의 반응물이 다른 양이온보다 반응성이 없다면, 반응은 발생하지 않는다. 어떤 경우에는 역 반응이 선호되지만 전진 반응은 아닙니다.
음이온 교체 예
양이온 대체 대신, 단일 대체 반응은 음이온을 포함 할 수있다. 실제로, 단일 대체 반응에 참여하는 유일한 음이온은 할로겐 (불소, 염소, 브롬, 요오드)입니다. 반응의 일반적인 형태는 다음과 같습니다.
A + BC → BA + C
단일 대체 반응 일뿐 아니라 이것은 산화 감소 또는 산화 환원 반응이기도합니다. 음이온 대체 반응의 예는 다음과 같습니다.
- cl 2 + 2 NABR → 2 NaCl + Br 2
- br 2 + 2 ki → 2 kbr + i 2
다시, 원소 반응물이 다른 음이온보다 더 반응하지 않으면 반응이 발생하지 않을 것이다. 예를 들어, 다음 반응은 발생하지 않습니다.
i 2 + 2 KBR → 반응 없음
단일 대체 반응의 산물을 결정하는 방법
단일 대체 반응의 산물은 예측하기에 쉽습니다. 순수한 원소가 할로겐이라면, 화합물에서 다른 할로겐을 대신합니다. 모든 할로겐은 산화 상태가 동일하므로 간단한 대체입니다.
그러나 원소 반응물이 할로겐이 아닌 경우 화합물의 양이온을 대체합니다. 두 양이온이 항상 같은 산화 상태를 갖는 것은 아닙니다. 양이온과 음이온의 전하의 균형을 맞추고 화학 방정식의 균형을 잡아 필요한 것을 얻을 수 있습니다.
예를 들어, 반응을 고려하십시오 :
mg (s) + alpo 4 (aq) →
마그네슘은 알루미늄보다 반응성이 높기 때문에 교체가 유리합니다. 그러나 알루미늄 양이온에는 +3의 전하가 있습니다 (po 4 의 균형 음이온), 마그네슘 이온 (희토류 금속으로)은 +2의 전하가 있습니다.
먼저, 양이온 및 음이온 전하의 균형을 잡아 제품의 공식을 찾으십시오.
.
mg (s) + alpo 4 (aq) → al (s) + mg 3 (po 4 )
그런 다음 화학 방정식의 균형을 맞추기 위해 반응물과 제품 앞의 계수를 조정하십시오.
3 mg (s) + 2 alpo 4 (aq) → 2 al (s) + mg 3 (po 4 )
반응이 발생하는지 여부를 예측하기 위해 반응성 시리즈를 사용하여
반응성 시리즈를 사용하여 단일 대체 반응이 발생하는지 여부를 결정하십시오.
음이온 교체의 경우 할로겐의 반응성 시리즈는 다음과 같습니다.
대부분의 반응성 f 2 > cl 2 > br 2 > i
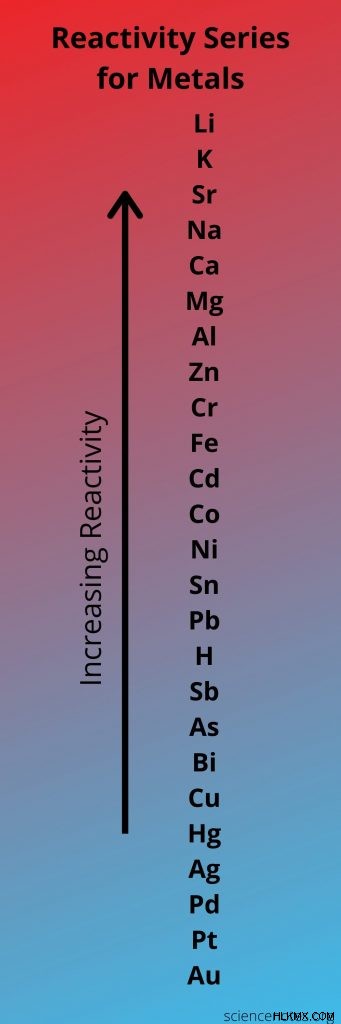
이것은 할로겐의 순서가주기적인 테이블에서 그룹을 내려가는 순서이므로 기억하기 쉽습니다. 할로겐이 주기성 테이블에 높을수록 반응성이 높습니다. 따라서 cl 2 i 2 를 대체합니다 단일 대체 반응에서는 음이온에 불소 이온이 있으면 반응하지 않습니다.
양이온에 대한 반응성 시리즈는 더 길고 명백하지 않습니다. 최소 반응성 금속은 H (aq) 이온과 반응하지 않지만, 가장 반응성이 가장 높은 금속은 이온과 반응 할뿐만 아니라 수소 이온을 액체 물에서 당길 수도 있습니다. 중간의 요소는 H (aq) 이온과 반응하고 때로는 수증기에서 수소를 당길 수 있습니다.
그러나 일반 화학 클래스의 경우 주로 어떤 금속이 서로를 대체 할 수 있는지, 어떤 금속을 대체 할 수 없는지 알아야합니다. 예를 들어, 아연 (Zn)은 주석 (SN)을 화합물의 양이온으로 대체 할 수 있지만 칼륨 (k)을 대체 할 수는 없습니다. 일반적으로 알칼리 금속은 가장 반응성이 높으며 알칼리성 지구 금속이 뒤 따릅니다. 대조적으로 고귀한 금속은 상대적으로 반응하지 않습니다.
참조
- Barke, Hans-dieter; Hazari, Al; Yitbarek, Sileshi (2008). 화학 교육의 인식을 다루는 화학의 오해 . 베를린 :스프링거. ISBN 3540709894.
- 브라운, 시어 도어; et al. (2017) 화학 :중앙 과학 (14 번째 ed.). 피어슨. ISBN 9780134414232
- Myers, Richard (2009). 화학의 기초 . 그린 우드 출판 그룹. ISBN 978-0-313-31664-7.