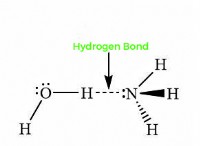
1. 이온 결합 :
* 바륨 (BA)은 그룹 2의 금속이며, 이는 +2 양이온 (BA²⁺)을 형성하기 위해 2 개의 전자를 쉽게 잃게됩니다.
* 염소 (CL)는 그룹 17에서 비금속이며, 하나의 전자를 쉽게 얻기 위해 -1 음이온 (CL)을 형성합니다.
2. bacl₂의 형성 :
* 전기 중립성을 달성하기 위해 하나의 바륨 원자 (BA²⁺)는 2 개의 염소 원자 (2 cl⁻)와 결합됩니다.
* 반대로 하전 된 이온 사이의 정전기 인력은 Bacl₂에서 이온 결합을 생성합니다.
3. 루이스 구조 표현 :
* 우리는 Bacl₂과 같은 이온 성 화합물에 대한 전통적인 루이스 구조를 그리지 않습니다.
* 대신, 우리는 이온을 개별적으로 나타냅니다.
* ba² [:[ba] ²⁺ (2 개의 전자가 제거 된 바륨 원자)
* CL⁻ :[CL] ⁻ (하나의 전자가 추가 된 염소 원자)
* BACL bac의 구조는 결정질 격자이며, 여기서 각각의 바이온은 6 개의 클리온으로 둘러싸여 있으며, 각각의 클로 이온은 6 개의 바이온으로 둘러싸여 있습니다.
요약 : BACLic은 BA²⁺와 Cll 이온 사이의 정전기 인력에 의해 함께 유지 된 이온 성 화합물입니다. 그것은 이온 결합의 특성으로 인해 전통적인 루이스 구조를 형성하지 않습니다.