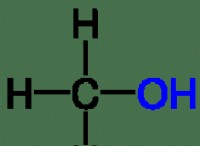
1. 물에있는 fe² b 이온 : FESOol가 물에 용해되면 Fe²⁺ 및 SoJoment 이온으로 분리됩니다.
2. 가수 분해 : Fe²⁺ 이온은 물 분자와 상호 작용하여 물의 산소 원자에서 전자를 수용합니다. 이것은 수화 된 철 이온, [fe (h₂o) ₆] ²⁺을 형성합니다.
3. 산 형성 : 전자에 대한 Fe²⁺ 이온의 매력은 물 분자의 O-H 결합을 약화시켜 물 분자가 양성자를 잃는 것을 더 쉽게합니다 (H⁺). 이는 용액의 산도를 담당하는 히드로 늄 이온 (HATER)의 형성을 초래한다.
반응은 다음과 같이 표현 될 수있다
[fe (h )o) ₆] ²⁺ ⇌ [fe (h₂o) ₅ (OH)] ⁺ + h₃o⁺
간단한 용어로 :
* Fe²⁺ 이온은 전자를 물 분자로부터 멀리 잡아 당깁니다.
* 이것은 물 분자를 더 산성으로 만들어서 이온을 방출합니다.
* 용액으로의 이온이 방출되면 산성이됩니다.
키 포인트 : FESO₄ 용액의 산도는 강산 (H₂SOA)의 컨쥬 게이트 염기 인 SOJONRA 이온에 의한 것이 아니므로 용액의 pH에 크게 기여하지 않는다.