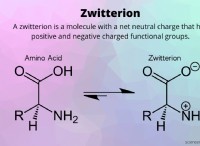
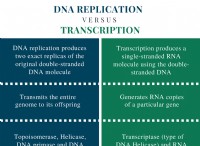
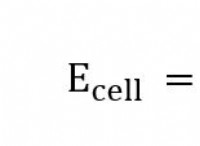* 전자 확률 : 궤도의 모양은 핵 주변의 특정 영역에서 전자를 찾을 확률을 나타냅니다.
* s 궤도 구형은 전자가 핵으로부터 어떤 방향 으로든 발견 될 확률이 동일하다는 것을 의미한다.
* p orbitals 핵의 반대쪽에 2 개의 로브가있는 아령 모양을 갖는데, 이는 해당 영역에서 전자를 찾을 확률이 높음을 나타냅니다.
* d orbitals 더 복잡하고 전자 확률 분포가 다른 다양한 모양 (클로버 잎, 도넛 모양 등)을 가질 수 있습니다.
* 에너지 수준 : 궤도의 모양은 또한 전자의 에너지 수준에 영향을 미칩니다.
* 주어진 원칙적 양자 수 (n)의 경우, 다른 모양 (S, P, D, F)을 갖는 궤도는 약간 다른 에너지를 갖는다.
*이 에너지의 차이는 원자의 특정 전자 구성을 결정하는 것입니다.
* 화학 결합 : 궤도의 모양은 화학적 결합에 중요한 역할을합니다.
* 원자가 상호 작용하면 궤도가 겹쳐서 분자 궤도를 형성합니다.
* 원자 궤도의 모양은 결과 결합의 모양과 강도를 결정합니다.
* 분광 특성 : 궤도의 모양은 또한 원자와 분자의 고유 한 스펙트럼 특성을 담당합니다.
* 다른 궤도는 특정 파장에서 빛을 흡수하고 방출하여 특성 흡수 및 방출 스펙트럼을 초래합니다.
요약 : 궤도의 모양은 전자가 발견 될 수있는 곳, 에너지 수준, 다른 원자와 상호 작용하는 방법 및 원자의 전반적인 거동에 기여하는 위치를 지시합니다.