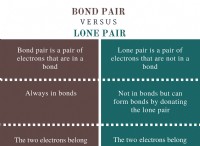
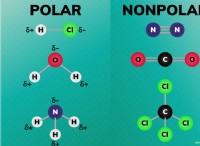
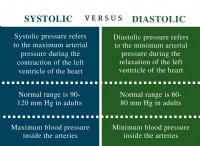
1. 이상적인 가스 혼합 방정식 :
혼합 이상적인 가스의 엔트로피 변화는 다음과 같습니다.
ΔS_MIX =-r * σ (n_i * ln (x_i))
어디:
* ΔS_MIX 혼합의 엔트로피 변화입니다.
* r 이상적인 가스 상수 (8.314 J/mol · K)입니다.
* n_i 가스 성분 'i'의 두더지 수입니다.
* x_i 가스 성분 'i'(n_i / 총 두더지)의 두더지 분율입니다.
2. 계산 단계 :
* 가스를 식별 : 혼합물에 관련된 개별 가스 성분을 결정하십시오.
* 두더지 분획을 결정하십시오 : 혼합물에서 각 가스 성분의 몰 분율을 계산하십시오.
* 엔트로피 변화를 계산합니다. N_I 및 X_I의 값을 이상적인 가스 혼합 방정식으로 대체하십시오.
3. 예 :
2 몰의 질소 (N2)와 3 몰의 산소 (O2)가 혼합되어 있다고 가정 해 봅시다.
* n_n2 =2 몰, n_o2 =3 몰
* 총 두더지 =2 + 3 =5 몰
* x_n2 =2/5 =0.4, x_o2 =3/5 =0.6
이제 이러한 값을 방정식으로 대체하십시오.
ΔS_MIX =-8.314 J/MOL · K * (2 * ln (0.4) + 3 * ln (0.6))
ΔS_MIX ≈ 11.53 J/K
이것은 2 몰의 N2를 3 몰의 O2와 혼합하는 엔트로피 변화가 약 11.53 J/K임을 의미합니다.
중요한 메모 :
*이 방정식은 이상적인 가스에만 적용됩니다 . 실제 가스는 특히 높은 압력에서 이상적인 행동에서 벗어날 수 있습니다.
* 혼합의 엔트로피는 항상 양수입니다. 이것은 이상적인 가스가 혼합 될 때 시스템의 엔트로피가 증가하여 더 큰 수준의 장애를 반영한다는 것을 의미합니다.
* 엔트로피 변화는 초기 온도와 무관합니다.
이 단계를 따르고 제공된 방정식을 사용하여 다른 가스 혼합물에 대한 혼합의 엔트로피 변화를 계산할 수 있습니다.