기본 아이디어 :
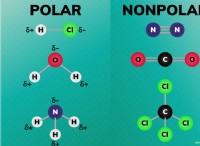
* 극성 : 용해도를 이해하기위한 열쇠는 극성의 개념입니다. 분자는 극성 (고르지 않은 전하 분포) 또는 비극성 (균일 한 전하 분포) 일 수 있습니다.
* 극성 분자 : 물을 생각해보십시오.
* 비극성 분자 : 오일을 생각하십시오 - 탄소와 수소 원자는 전자를 동등하게 공유하므로 전하가 없습니다.
* "좋아요"는 비슷한 의미입니다. 원리는 비슷한 극성을 가진 물질이 서로 녹는 경향이 있다고 말합니다.
* 극성 용매는 극성 용질을 용해시킨다 : 극성 용매 인 물은 극성 용질 인 설탕을 쉽게 녹일 것입니다.
* 비극성 용매는 비극성 용질을 용해시킨다 : 비극성 용매 인 오일은 비극성 용질 인 그리스를 용해시킵니다.
왜 이것이 작동합니까?
* 분자간 힘 : 분자 (분자간 힘) 사이의 매력은 중요한 역할을합니다.
* 극성 분자 강한 수소 결합 또는 쌍극자-쌍극자 상호 작용을 형성합니다. 이러한 상호 작용은 다른 극성 분자를 용해시키는 데 도움이됩니다.
* 비극성 분자 약한 런던 분산 세력을 형성합니다. 이 힘은 또한 비극성 용매가 비극성 용질을 용해시키는 이유입니다.
예 :
* 물 (Polar)은 소금 (이온, 극) :를 용해시킵니다 소금 이온 (Na⁺ 및 Cl⁻)은 극성 물 분자에 끌려 이온 결합을 분리하고 소금이 용해 될 수 있습니다.
* 오일 (비극성)은 그리스를 용해시킵니다 (비극성) : 오일과 그리스는 모두 비극성 인 탄화수소의 긴 사슬로 구성됩니다. 그들 사이의 약한 런던 분산 힘은 쉽게 혼합 할 수 있습니다.
* 물 (Polar)은 오일 (비극성) :를 용해시키지 않습니다 비극성 오일 분자와의 약한 상호 작용으로 인해 수 분자 내의 강한 상호 작용은 쉽게 파괴되지 않습니다. 그들은 별도의 상태로 유지됩니다.
예외 및 고려 사항 :
* 중간 극성 : 일부 분자는 혼합 된 극성 (예를 들어, 에탄올)을 갖는다. 그것들은 극성 및 비극성 용매 모두에 용해 될 수 있지만, 그들의 용해도는 제한 될 수 있습니다.
* 온도 : 용해도는 종종 온도에 따라 증가합니다. 온도가 상승함에 따라 더 많은 에너지가있어 용질을 고정시키는 분자간 힘을 파괴합니다.
* 압력 : 압력은 액체 나 고체보다 가스의 용해도에 더 큰 영향을 미칩니다. 압력 증가는 일반적으로 가스의 용해도를 증가시킵니다.
요약 : 용해도를 예측하는 데 "용해와 같은 것과 같은"의 원리를 이해하는 것이 필수적입니다. 용매 및 용질의 극성을 고려하면 물질이 특정 용매에 용해 될지 여부에 대한 정보에 근거한 결정을 내릴 수 있습니다.