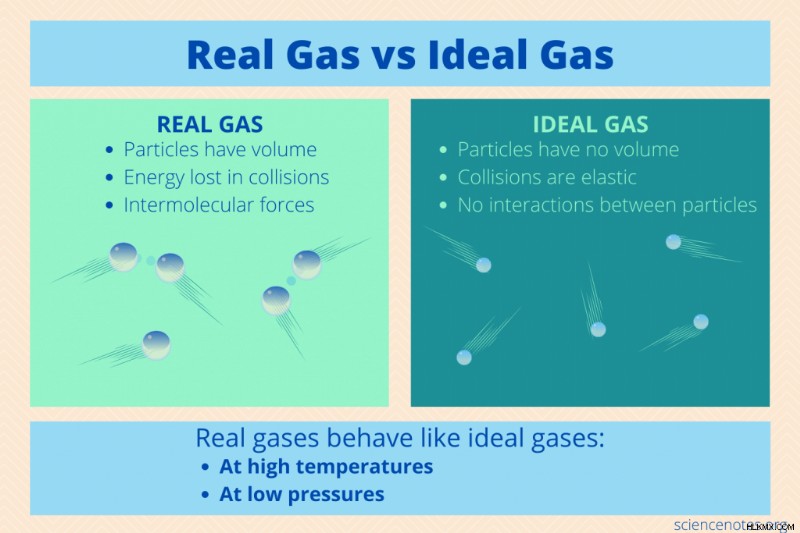
이상적인 가스 이상적인 가스에 따라 동작하는 가스이며 비 이상적이거나 실제 가스 이상적인 가스 법칙에서 벗어나는 가스입니다. 그것을 보는 또 다른 방법은 이상적인 가스는 이론 가스이며 실제 가스는 실제 가스라는 것입니다. 다음은 이상적인 가스와 실제 가스의 특성, 이상적인 가스 법칙을 적용하는 것이 적절한 경우, 실제 가스를 다룰 때해야 할 일을 살펴 봅니다.
이상적인 가스 법칙
이상적인 가스 법률은 이상적인 가스 법을 따릅니다 :
pv =nrt
P는 압력, v는 부피, N은 가스의 두더지 수이고, R은 가스 상수, T는 절대 온도입니다.
.이상적인 가스 법칙은 화학적 정체성에 관계없이 모든 이상적인 가스에 작용합니다. 그러나 특정 조건에서만 적용되는 상태 방정식입니다. 입자가 완벽하게 탄성 충돌에 참여하고 부피가 없으며 충돌을 제외하고는 서로 상호 작용하지 않는다고 가정합니다. 다시 말해, 가스는 가스의 동역학 분자 이론에 따라 동작합니다.
실제 가스와 이상적인 가스 사이의 유사성
실제 및 이상적인 가스는 특정 가스의 특정 특성을 공유합니다.
- 질량 :실제 및 이상적인 가스 입자 모두 질량이 있습니다.
- 저밀도 :가스는 액체 나 고체보다 훨씬 덜 밀도가 높습니다. 대부분의 경우 가스 입자는 이상적인 가스와 실제 가스에서 서로 멀리 떨어져 있습니다.
- 낮은 입자 부피 :가스는 조밀하지 않기 때문에 가스 입자의 크기 또는 부피는 입자 사이의 거리에 비해 매우 작습니다.
- 모션 :이상적이고 실제 가스 입자에는 운동 에너지가 있습니다. 가스 입자는 충돌 사이의 직선으로 무작위로 움직입니다.
이상적인 가스 법칙은 많은 실제 가스가 두 가지 조건에서 이상적인 가스처럼 행동하기 때문에 매우 유용합니다.
- 저압 :우리가 일상 생활에서 겪는 많은 가스는 상대적으로 낮은 압력입니다. 입자가 근접하게되도록 충분히 높으면 압력이 요인이됩니다.
- 고온 :가스의 맥락에서, 고온은 기화 온도보다 훨씬 높은 온도입니다. 따라서 실내 온도조차도 실제 가스 입자에게 이상적인 가스처럼 작용할 수있는 충분한 운동 에너지를 줄 정도로 뜨겁습니다.
Real Gas vs 이상적인 가스
일반적인 조건에서 많은 실제 가스는 이상적인 가스처럼 행동합니다. 예를 들어 :공기, 질소, 산소, 이산화탄소 및 고귀한 가스는 실내 온도와 대기압 근처의 이상적인 가스 법칙을 따릅니다. 그러나 실제 가스가 이상적인 가스 거동에서 벗어나는 몇 가지 조건이 있습니다.
- 고압 :고압력 가스 입자는 서로 상호 작용할 정도로 충분히 가까워집니다. 또한 분자 사이의 거리는 더 작기 때문에 입자 부피가 더 중요합니다.
- 저온 :저온에서 가스 원자와 분자는 운동 에너지가 적습니다. 충돌 중에 입자와 에너지 사이의 상호 작용이 중요 할 정도로 천천히 움직입니다. 이상적인 가스는 액체 나 고체로 변하지 않지만 실제 가스는 그렇습니다.
- 무거운 가스 :밀도가 높은 가스에서 입자는 서로 상호 작용합니다. 분자간 힘이 더 분명합니다. 예를 들어, 많은 냉매는 이상적인 가스처럼 행동하지 않습니다.
- 분자간 힘을 가진 가스 :일부 가스의 입자는 서로 쉽게 상호 작용합니다. 예를 들어, 수소 결합은 수증기에서 발생합니다.
실제 가스는 다음과 같습니다.
- 반 데르 발스 세력
- 압축성 효과
- 가변 비열 용량
- 가변 구성
- 비평 형 열역학적 효과
- 화학 반응
실제 가스와 이상적인 가스 간의 차이 요약
| 차이 | 실제 가스 | 이상적인 가스 |
|---|---|---|
| 입자 부피 | 명확한 볼륨 | 아니요 또는 무시할 수있는 볼륨 |
| 충돌 (컨테이너와 서로) | 비 탄성적 인 | 탄성 |
| 분자 력 | 예 | 아니요 |
| 상호 작용 | 입자가 상호 작용하고 반응 할 수 있습니다 | 충돌 외에는 상호 작용이 없습니다 |
| 위상 전이 | 예, 위상 다이어그램에 따라 | 아니요 |
| 가스 법률 | van der waals 방정식 | 이상적인 가스 법칙 |
| 는 실제 세계에 존재합니다 | 예 | 아니요 |