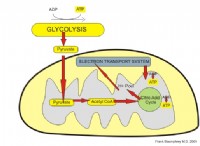
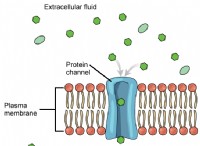
1. 전자 구성 :
* 붕소 : 붕소의 구성은 [He] 2S² 2p¹입니다. 그것은 3 개의 원자가 전자 만 있으므로 비금속으로 만듭니다.
* 전이 금속 : 전이 금속은 주기율표의 d- 블록을 차지합니다. 그들은 지상 상태 또는 일반적인 산화 상태 중 하나에 부분적으로 채워진 d- 궤도가 있습니다. 이를 통해 다양한 산화 상태를 나타내고 다양한 결합 상호 작용에 참여할 수 있습니다.
2. 금속 특성 :
* 붕소 : 붕소는 메탈 로이드이며 금속과 비 메탈의 특성을 나타냅니다. 열과 전기의 열악한 도체입니다.
* 전이 금속 : 전이 금속은 금속성이 매우 높으며, D- 궤도에서 전자의 비편성으로 인해 열과 전기의 전도도가 우수합니다. 그것들은 가단성, 연성이며 광택입니다.
3. 산화 상태 :
* 붕소 : 붕소는 주로 +3 산화 상태를 나타냅니다.
* 전이 금속 : 전이 금속은 광범위한 산화 상태를 나타내며, 종종 D- 전자로 인해 다수의 양성 산화 상태를 나타낸다. 이 변동성은 전이 금속의 풍부하고 다양한 화학을 담당합니다.
4. 결합 행동 :
* 붕소 : 붕소는 다른 원자와 공유 결합을 형성하여 종종 3- 센터 2- 전자 결합 (예 :보란에서)을 형성합니다.
* 전이 금속 : 전이 금속은 비금속과의 이온 결합을 쉽게 형성하며 공유 결합을 형성 할 수도 있습니다. 이들은 전이 금속 이온이 리간드로 둘러싸인 중심 원자로서 작용하는 복잡한 배위 화합물에 종종 참여한다.
5. 자기 특성 :
* 붕소 : 붕소는 디아마그네틱하여 자기장에 의해 반발됩니다.
* 전이 금속 : 많은 전이 금속은 상자성을 나타내며, 이는 D- 궤도의 쌍이없는 전자로 인해 자기장에 끌립니다. 일부 전이 금속은 또한 강자성이므로 외부 필드가 제거 된 후에도 자기 특성을 유지합니다.
6. 반응성 :
* 붕소 : 붕소는 실온에서 상대적으로 반응하지 않지만 더 높은 온도에서 산소 및 할로겐과 같은 특정 요소와 반응 할 수 있습니다.
* 전이 금속 : 전이 금속은 주기율표 및 기타 요인의 위치에 따라 반응성이 다릅니다. 금과 백금과 같은 일부는 매우 반응하지 않지만 나트륨 및 칼륨과 같은 다른 일부는 매우 반응성이 높습니다.
7. 응용 프로그램 :
* 붕소 : 붕소는 유리 생산, 살충제 및 원자로를 포함한 다양한 분야에서 응용을 발견합니다.
* 전이 금속 : 전이 금속에는 건축 자재, 촉매, 전자 제품 및 안료를 포함한 광범위한 응용이 있습니다.
요약하면, 붕소 및 전이 금속은 전자 구성, 금속 특성, 산화 상태, 결합 거동, 자기 특성, 반응성 및 응용 분야에서 근본적으로 다릅니다. 붕소의 비금속 특성 및 제한된 원자가 전자는 금속 특성, 가변 산화 상태 및 전이 금속의 복잡한 결합과 차별화됩니다.