1. 강한 산 + 강한베이스 :
* 결과 소금은 중립적입니다.
* 용액의 pH는 약 7 입니다. , 중립성을 나타냅니다.
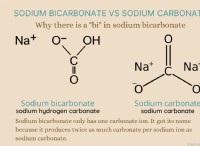
* 예 :HCl (강산) + NaOH (강한 염기) → NaCl (중성 소금) + H₂O
2. 약산 + 강한베이스 :
* 결과 소금은 약간 기본적입니다.
* 용액의 pH는 가 7 보다 클 것입니다. 약간 기본적인 솔루션을 나타냅니다.
* 예 :Choocooh (약산) + naoh (강한베이스) → Ch₃coona (약간 기본적인 소금) + h₂o
3. 강산 + 약한베이스 :
* 결과 소금은 약간 산성입니다.
* 용액의 pH는 가 7 보다 작습니다. , 약간 산성적인 용액을 나타냅니다.
* 예 :HCl (강산) + NH₃ (약한 염기) → NH₄CL (약간 산성 염) + H₂O
4. 약산 + 약한 염기 :
* 생성 된 소금의 pH는 산과 염기의 상대 강도에 따라 다릅니다.
* 산이 더 강하면 용액은 약간 산성이됩니다 (pH <7).
*베이스가 더 강하면 솔루션은 약간 기본적입니다 (pH> 7).
* 산과 염기가 동일한 강도 인 경우 용액은 중립에 가깝습니다 (pH ≈ 7).
키 포인트 :
* 중화 반응은 산과 염기 사이의 반응입니다.
* 중화 반응의 생성물은 소금과 물입니다.
* 결과 용액의 pH는 사용 된 산 및 염기의 강도에 따라 다릅니다.
* 강산 및 염기는 용액에서 완전히 이온화되는 반면, 약산과 염기는 부분적으로 이온화됩니다.
다른 질문이 있으면 알려주세요!