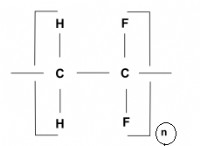
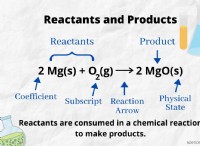
물의 이온 형성에 기초한 산과 염기 비교 :
산 :
* 이온 형성 : 물에 용해 될 때, 산은 수소 이온 (H+) 를 방출한다 .
* 예 : 염산 (HCL)은 수중에 분리되어 수소 이온 (H+) 및 클로라이드 이온 (CL-)을 형성합니다.
* HCL (AQ) → H + (AQ) + CL- (AQ)
베이스 :
* 이온 형성 : 물에 용해 될 때, 염기 방출 수산화 이온 (OH-) .
* 예 : 수산화 나트륨 (NaOH)은 물에 분리되어 나트륨 이온 (Na+) 및 수산화 이온 (OH-)을 형성합니다.
* naoh (aq) → na + (aq) + Oh- (aq)
주요 차이점 :
* 유형의 이온이 방출 : 산은 h+를 방출하는 반면, 염기는 OH-를 방출한다.
* pH : 산은 7보다 낮은 pH를 가지며, H+ 농도가 높고, 염기는 7보다 높은 pH를 가지며, 이는 더 높은 OH- 농도를 나타낸다.
* 화학적 특성 : 산은 사워 맛이며 금속과 반응하여 수소 가스를 생성하고베이스를 중화시킬 수 있습니다. 베이스는 쓴 맛이 좋고 터치에 미끄러 져 산을 중화시킵니다.
요약 :
산과 염기의 주요 차이점은 물에 용해 될 때 방출되는 이온의 유형에 있습니다. 산은 수소 이온 (H+)을 방출하여 pH를 낮추고 염기는 수산화물 이온 (OH-)을 방출하여 pH가 더 높다. 이온 형성의 이러한 차이는 그들의 독특한 화학적 특성과 상호 작용을 유발합니다.