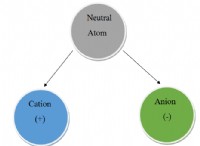
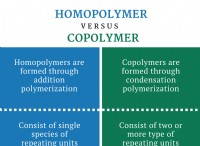
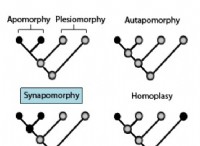
이유는 다음과 같습니다.
* 혼성화 : HC2의 탄소 원자는 SP 하이브리드 화된다. 이것은 2 개의 SP 하이브리드 궤도와 2 개의 Unbridized p orbital을 가지고 있음을 의미합니다.
* 본딩 : 2 개의 탄소 원자는 각 탄소로부터 하나의 SP 하이브리드 궤도를 사용하여 트리플 결합 (하나의 시그마 및 2 개의 PI 결합)을 형성한다. 하나의 탄소에서 나머지 SP 하이브리드 궤도는 수소 원자와 시그마 결합을 형성합니다. 각각의 탄소 원자상에서 구조화되지 않은 P 궤도는 두 개의 PI 결합을 형성합니다.
* 선형 형상 : SP 혼성화는 각 탄소 원자 주위에 선형 기하학을 초래합니다.
따라서, 분자는 180도 결합 각도를 갖는 선형 모양을 갖는다.