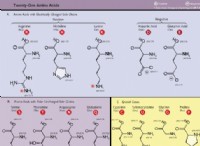
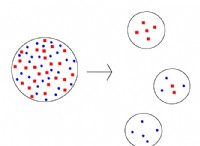
* 이온 성 화합물 : NaCl (표 염)은 이온 성 화합물입니다. 물에 용해되면 구성 이온으로 분리됩니다.
* naation (나트륨 양이온)
* CL an (클로라이드 음이온)
* 가수 분해 : 이온 자체는 중립적이지만 물 분자와 상호 작용할 수 있습니다. 가수 분해로 알려진 이러한 상호 작용은 용액의 pH에 영향을 줄 수 있습니다.
* 약간의 산도 : 클로라이드 이온 (Cl⁻)은 물 분자로부터 양성자 (H⁺)를 수용하는 경향이 매우 적습니다. 이는 이온의 농도가 매우 작은 증가로 이어져 용액이 매우 약간 산성이됩니다.
따라서 NaCl 용액은 일반적으로 일상적인 사용에서 중립으로 간주되지만 염화물 이온의 가수 분해로 인해 기술적으로 약간 산성이 있습니다. 산도는 너무 작아서 대부분의 목적에 대해 실질적으로 무시할 수 있습니다.