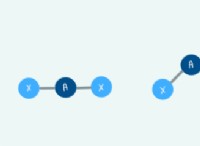
* 공유 결합을 좌표 : 이들은 하나의 원자가 공유 쌍에 * 둘 다 * 전자를 제공하는 특수 유형의 공유 결합입니다. 두 전자를 제공하는 원자를 공여자 라고합니다 전자를 수신하는 원자를 수용기 라고합니다. .
* 일반 공유 결합 : 일반 공유 결합에서, 각 원자는 하나의 전자를 기여하여 공유 쌍을 형성한다.
예 : 암모늄 이온 (NH₄⁺)의 형성을 고려하십시오.
1. 질소 (N) 원자 : 질소에는 5 개의 원자가 전자가 있습니다. 3 개의 수소 원자 (H)와 3 개의 정규 공유 결합을 형성 할 수 있습니다. 이것은 하나의 고독한 전자 쌍으로 질소를 남깁니다.
2. 수소 이온 (H⁺) : 수소 이온에는 전자가 없습니다.
3. 공유 본드 좌표 : 고독한 쌍의 질소는 공여자 원자 역할을합니다. 수용체 원자 역할을하는 수소 이온과 두 전자를 공유합니다. 이것은 암모늄 이온 (NH₄⁺)을 형성합니다.
키 포인트 :
* 기증자 : 고독한 전자 쌍의 원자.
* 수용자 : 전자가없고 전자 쌍을 받아들이는 원자.
* 공유 전자 : 전자는 공여자 원자에서만 나옵니다.
더 많은 예제 나 설명을 원하시면 알려주세요!