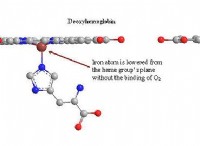
다음은 고장입니다.
* 관중 이온 용액에 존재하지만 반응 동안 화학적 동일성을 변화시키지 않는 이온입니다. 그들은 단순히 반응을 "관찰"하고 있습니다.
* 반응물이 가용성 염인 결과로 일반적으로 존재합니다. 이 소금이 용해되면, 그들은 그들의 구성 이온에 분리된다.
* 그들은 순 이온 방정식에 나타나지 않습니다 반응에 직접 관여하는 종 만 보여줍니다.
예 :
수용액에서 질산은 (Agno₃)과 염화나트륨 (NaCl) 사이의 반응을 고려하십시오.
* 분자 방정식 : agno₃ (aq) + NaCl (aq) → agcl (s) + nano₃ (aq)
* 완전한 이온 방정식 : ag⁺ (aq) + no₃⁻ (aq) + na⁺ (aq) + cl⁻ (aq) → agcl (s) + na⁺ (aq) + no₃⁻ (aq)
* 순 이온 방정식 : ag⁺ (aq) + cl⁻ (aq) → agcl (s)
이 반응에서, 나트륨 (na⁺) 및 질산염 (No₃⁻) 이온 관중 이온입니다. 그것들은 용액에 존재하지만 침전물, 염화은 (Agcl)의 형성에 참여하지 않습니다.
관중 이온을 이해하면 화학 반응을 단순화하고 발생하는 필수 화학적 변화에 중점을 둡니다.