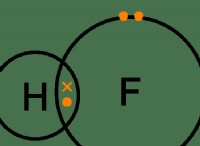
* 옥트 규칙 : 옥트 규칙은 원자가 전자가 가장 바깥 쪽 쉘 (원자가 쉘)에서 8 개의 전자의 안정적인 구성을 달성하기 위해 전자를 얻거나 잃거나 공유하는 경향이 있다고 명시한다.
* 예외 : 모든 원자가 옥트 규칙을 엄격하게 따르는 것은 아닙니다. 이유는 다음과 같습니다.
* 수소 (H) : 수소는 가장 바깥 쪽 쉘 (1s 궤도)을 채우기 위해 두 개의 전자 만 있으면됩니다. 옥틴 규칙이 아닌 듀엣 규칙입니다.
* 산소 (O) : 산소는 전형적으로 2 개의 공유 결합을 형성하여 8 개의 전자 (자체 쉘에서 6 개 및 공유 2)로 안정적인 구성을 달성합니다.
* Bromine (br) : 브로민은 그룹 17 (할로겐)에 있으며 일반적으로 하나의 공유 결합을 형성하여 8 개의 전자로 낙지를 완성합니다. 그러나 특정 조건 (예 :BRF5)에서 옥셋을 확장 할 수도 있습니다.
따라서 목록에서 항상 옥넷 규칙을 엄격하게 따르는 유일한 원자는 산소 (O)입니다.