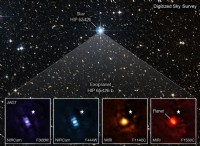
메탄올 (CH3OH) 용해도 :
* 극성 : 메탄올은 극성 분자입니다. 산소 원자는 탄소 및 수소 원자보다 전기 음성이므로 산소에 부분 음전하와 탄소 및 수소에 부분 양전하가 생성됩니다. 이 극성은 메탄올이 물 분자와 수소 결합을 형성 할 수있게한다.
* 수소 결합 : 메탄올은 물 분자와 수소 결합을 형성 할 수 있습니다. 메탄올의 하이드 록실 그룹 (OH)의 수소 원자는 물 분자에서 산소 원자와 수소 결합을 형성 할 수있다. 이러한 수소 결합은 물에서 메탄올의 용해도에 기여하는 강한 분자간 힘이다.
벤젠 (C6H6) 용해도 :
* 비극성 : 벤젠은 비극성 분자입니다. 벤젠의 탄소-하이드로겐 결합은 비극성이며, 분자는 대칭 구조를 갖는다. 이러한 극성 부족은 벤젠이 물 분자와의 강한 상호 작용을 형성하는 것을 방지합니다.
* 소수성 특성 : 벤젠의 비극성 특성은 그것을 소수성 (물 반복)으로 만듭니다. 그것은 다른 비극성 분자와 상호 작용하는 것을 선호합니다.
주요 차이 :
메탄올과 벤젠의 주요 차이점은 극성입니다. 물은 극성 용매이며, 수소 결합을 통해 메탄올과 같은 극성 분자를 쉽게 용해시킨다. 벤젠은 비극성 용매이며, 비극성 분자를 용해시킬 것이지만, 메탄올과 같은 극성 분자를 용해 시키지는 않습니다.