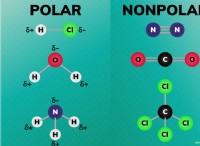
물 (H (O) :
* 구성 : 하나의 산소 원자 (O)에 결합 된 2 개의 수소 원자 (H).
* 본딩 : 공유 결합 - 전자는 원자 사이에 공유됩니다.
* 극성 : 물은 극성 분자이며, 이는 양의 말단 (수소 원자 근처)과 음의 끝 (산소 원자 근처)을 갖는 것을 의미합니다. 이 극성은 특성에 중요합니다.
* 물질의 상태 : 실온에서 액체. 고체 (얼음) 또는 가스 (수증기)로 존재할 수도 있습니다.
* 속성 :
* 우수한 용매 (많은 물질을 용해 함).
* 분자들 사이의 강한 수소 결합으로 인한 높은 끓는점 및 융점.
* 많은 화학 반응에서 반응물 역할을합니다.
소금 (NaCl) :
* 구성 : 하나의 나트륨 원자 (NA)는 하나의 염소 원자 (CL)에 결합된다.
* 본딩 : 이온 결합 - 전자는 나트륨 원자에서 염소 원자로 전달되어 서로를 끌어들이는 반대로 하전 된 이온을 만듭니다.
* 극성 : 충전이 고르게 분포되어 있기 때문에 소금은 극성이 아닙니다.
* 물질의 상태 : 실온에서 고체.
* 속성 :
* 물에 용해되어 이온을 형성합니다 (na⁺ 및 cl⁻).
* 물에 용해 될 때 전기를 전도합니다.
* 음식 양념 및 음식 보존을 포함하여 다양한 목적으로 사용됩니다.
주요 차이점 :
* 본딩 : 물은 공유 결합을 가지고 있고, 소금에는 이온 결합이 있습니다.
* 극성 : 물은 극성입니다. 소금이 아닙니다.
* 물질의 상태 : 물은 실온에서 액체입니다. 소금은 단단합니다.
* 속성 : 물은 극성으로 인해 독특한 특성을 가지고 있으며 소금은 용해시 전기의 좋은 지체입니다.
요약 : 물과 소금은 뚜렷한 구조, 결합 및 특성을 가진 근본적으로 다른 물질입니다. 그들의 차이는 원자가 배열되고 결합되는 방식에서 발생합니다.