엔탈피, 엔트로피 및 위상 변화의 관계
* 엔탈피 (H) : 시스템의 총 에너지를 나타냅니다. 위상 변화에서는 전환 중에 열이 흡수되거나 방출됩니다.
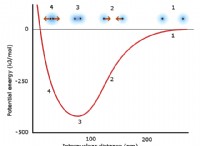
* 엔트로피 : 시스템의 무작위성 또는 장애를 측정합니다. 위상 변화에서, 시스템이보다 순서가 낮은 상태 (고체)에서 덜 정렬 된 상태 (액체, 가스)로 전환함에 따라 엔트로피가 증가한다.
* 깁스 자유 에너지 (g) : 이것이 주요 연결입니다. 엔탈피, 엔트로피 및 온도와 관련이 있습니다. g =h -ts .
녹는 점 및 끓는점 계산
1. 평형 조건 : 용융점 또는 비등점에서, 고체/액체 또는 액체/가스상은 평형 상태에있다. 이것은 두상의 깁스 자유 에너지가 동일하다는 것을 의미합니다. g (고체) =g (액체) 또는 g (액체) =g (가스)
2. 깁스 자유 에너지 사용 :
* 용융점 (TM) : g (고체) =H (고체) -TS (고체) 및 g (액체) =H (액체) -TS (액체). 그것들을 동일하게 설정하고 t에 대한 해결, tm =(H (액체) -H (고체)) / (s (액체) -S (고체)) 를 얻습니다.
* 끓는점 (TB) : 유사하게, g (액체) =H (액체) -TS (액체) 및 g (가스) =H (가스) -TS (가스). t : tb =(h (가스) -H (액체)) / (s (가스) -S (액체)) 해결
중요한 고려 사항
* 위상 변화의 엔탈피 및 엔트로피 : 특정 위상 전이 (용융, 끓는)에 엔탈피 및 엔트로피 변경이 필요합니다. 이들은 일반적으로 실험적으로 측정되거나 참조 표에서 발견됩니다.
* 압력 : 위의 방정식은 일정한 압력을 가정합니다. 용융 및 끓는점은 압력에 따라 변합니다.
* 근사 : 이러한 계산은 이론적이며 불순물, 분자간 힘 및 압력과 같은 요인에 의해 영향을받을 수 있습니다.
요약
엔탈피와 엔트로피 만 사용하여 용융점과 끓는점을 직접 계산할 수 없습니다. 또한 해당 엔트로피 값이 필요하고 깁스 자유 에너지 방정식을 사용하여 상이 평형 상태 인 온도를 해결하십시오.