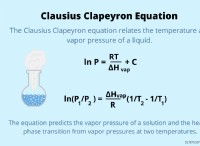
금속 :
* 이온 성 화합물을 형성하기 위해 : 비금속은 전자가 음으로 하전 된 이온 (음이온)이되는 경향이있는 반면, 금속은 전자가 긍정적으로 하전 된 이온 (양이온)이되는 경향이 있습니다. 이 반대로 하전 된 이온 사이의 인력은 이온 성 결합을 형성하여 이온 성 화합물의 형성을 초래한다. 예로는 NaCl (염화나트륨), MGO (산화 마그네슘) 및 CACL (클로라이드 칼슘)이 있습니다.
기타 비금속 :
* 공유 화합물을 형성하기 위해 : 비금속이 다른 비금속과 반응하면 전자를 공유하여 공유 결합을 형성합니다. 이 결합은 분자를 생성하며, 이는 HATE (물)처럼 단순하거나 c₁₂H₂₂O₁₁ (Sucrose)와 같은 복합체와 같이 간단 할 수 있습니다.
수소 :
* 산을 형성하기 위해 : 많은 비금속은 수소와 반응하여 산을 형성합니다. 예를 들어, 염소는 수소와 반응하여 염산 (HCl)을 형성하고, 황은 수소와 반응하여 황화수소 (HATS)를 형성합니다.
산소 :
* 산화물 형성 : 대부분의 비금속은 산소와 반응하여 산화물을 형성합니다. 이러한 반응은 종종 발열 (열 방출)이며 연소 (연소)로 이어질 수 있습니다. 그 예는 Co carbon (이산화탄소), SO₂ (이산화황) 및 p₄O₁₀ (인 펜 옥사이드)를 포함한다.
다른 일반적인 반응 :
halogens와 함께 * : 비금속은 할로겐 (불소, 염소, 브로민, 요오드 및 아스타틴)과 반응하여 다양한 화합물을 형성 할 수 있습니다.
* 질소 : 일부 비금속은 질소와 반응하여 암모니아와 같은 화합물을 형성합니다 (NH₃).
일반 트렌드 :
* 반응성은 그룹을 감소시킨다 : 주기성 테이블의 동일한 그룹 (열)의 비금속은 일반적으로 그룹을 아래로 이동할 때 덜 반응성이됩니다.
* 반응성은 한 기간에 걸쳐 증가합니다. 주기성 테이블의 같은 기간 (행)의 비금속은 일반적으로 왼쪽에서 오른쪽으로 이동할 때 더 반응성이 높아집니다.
예외 :
* 고귀한 가스 : 고귀한 가스는 안정적인 전자 구성으로 인해 매우 반응하지 않는 비금속 그룹입니다.
* 탄소 : 탄소는 긴 사슬과 복잡한 구조를 형성하는 능력이 독특하여 다양한 유기 화합물을 초래합니다.
이것은 일반화이며 비금속의 반응성은 특정 조건과 관련된 다른 요소에 따라 달라질 수 있습니다.