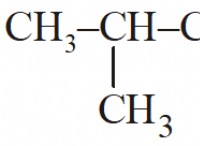극성 및 비극성 액체 :단순화 된 설명
작은 자석 그룹으로 액체를 상상해보십시오. 일부 자석은 강한 북쪽과 남극 (극)을 가지고 있고, 다른 자석은 약하거나 자기 풀 (비극성)이 없습니다. 이것은 액체의 분자가 행동하는 방식과 유사합니다.
극성 액체 :
* 분자는 강한 긍정적이고 부정적인 끝을 갖는다 전자의 고르지 않은 공유로 인해 (산소 측면이 약간 음수이고 수소 측면이 약간 양성인 물 분자를 생각하십시오).
* 다른 극성 분자에 끌렸다 (유인처럼) 강한 수소 결합을 형성합니다.
* 일반적으로 다른 극성 분자에 대한 좋은 용매 소금과 설탕처럼.
* 예 : 물, 에탄올, 아세톤.
비극성 액체 :
* 분자는 균형 잡힌 전하 분포를 갖는다 , 오일과 같은 뚜렷한 양의 또는 부정적인 끝이 없습니다.
* 다른 분자에 약하게 끌렸다 약한 반 데르 발스 세력을 형성합니다.
* 일반적으로 다른 비극성 분자에 대한 좋은 용매 지방과 기름처럼.
* 예 : 오일, 휘발유, 헥산.
키 테이크 아웃 :
* "." 극성 액체는 극성 물질을 용해시키고 비극성 액체는 비극성 물질을 용해시킨다.
*이 원칙은 물과 기름이 섞이지 않는 이유를 설명합니다 - 물은 극지이며 오일은 비극성입니다.
추가 세부 사항은 다음과 같습니다.
* 극성은 이진이 아닌 스펙트럼입니다. 일부 분자는 다른 분자보다 더 극성이며, 긍정적 인 말과 부정적인 목적 사이에 다양한 정도의 매력이 있습니다.
* 용해도는 극성 이외의 요인에 의해 영향을받습니다 온도 및 압력과 같은.
* 극성을 이해하는 것은 화학 및 생물학에서 중요합니다 , 세포막 구조 및 약물 전달과 같은 현상을 설명하는 데 도움이됩니다.
구체적인 예 또는 응용 프로그램에 대해 더 깊이 파고 들기를 원한다면 알려주십시오!