주요 차이 - 포화 대 불포화 탄화수소
탄화수소는 탄소와 수소 원자만을 함유하는 유기 화합물입니다. 탄화수소는 많은 유기 화합물의 모 화합물로 간주됩니다. 탄화수소의 주요 사슬은 C-C 결합에 의해 만들어지고, 수소 원자는 주 사슬의 탄소 원자에 부착된다. 탄소 원자 사이의 단일 또는 다중 결합의 존재에 기초하여, 탄화수소는 두 그룹으로 분류된다; 포화 탄화수소 및 불포화 탄화수소. 포화 탄화수소와 불포화 탄화수소의 주요 차이점은 포화 탄화수소가 탄소 원자 사이의 단일 공유 결합 만 포함한다는 것입니다. 불포화 탄화수소에는 주 사슬에 하나 이상의 이중 또는 삼중 공유 결합이 포함되어 있습니다 . 포화 및 불포화 탄화수소는 이러한 구조적 차이로 인해 다른 특성을 보여줍니다.
주요 영역이 적용됩니다
1. 포화 탄화수소
- 정의, 구조, 유형, 속성
2. 불포화 탄화수소
- 정의, 구조, 유형, 속성
3. 포화 및 불포화 탄화수소의 차이는 무엇입니까
- 주요 차이점 비교
주요 용어 :탄화수소, 포화 탄화수소, 불포화 탄화수소, 공유 결합, 알칸, 알켄, 알킨, 방향족 탄화수소

포화 탄화수소
단일 공유 결합에 의해 모든 탄소 원자가 다른 원자에 결합되는 탄화수소를 포화 탄화수소라고합니다. 따라서, 포화 탄화수소는 이중 또는 삼중 공유 결합을 포함한 다중 결합을 포함하지 않습니다. 이들 화합물에서, 각각의 탄소 원자는 4 개의 다른 원자에 직접 결합된다. 따라서, 모든 탄소 원자는 4 개의 결합을 만들어 완전히 점유된다. 이것이 이러한 화합물을 포화 탄화수소라고하는 이유입니다. 포화 탄화수소는 가장 단순하고 가장 극한 유기 천연 제품입니다. 포화 탄화수소의 예로는 알칸과 사이클로 알칸 패밀리가 포함됩니다.
가장 단순한 형태의 포화 탄화수소에는 메탄이 포함됩니다 (ch 4 ), 에탄 (c 2 H 6 ), 프로판 (c 3 H 8 ) 등. 포화 탄화수소는 화상을 입히고 공기 중에 파란색, 비 적시 불꽃을줍니다. 궁극적으로 많은 에너지를 방출하는 포화 탄화수소의 가연성으로 인해 포화 탄화수소는 종종 차량 및 비행기 엔진의 연료 공급원으로 사용됩니다. 잘 알려진 LPG 또는 요리 가스는 또한 부탄 (c 4 라는 포화 탄화수소입니다. H 10 ). 공기와 알칸의 연소는 이산화탄소 가스, 수증기, 열 및 빛을 초래합니다. 탄화수소는 일반적으로 화석화 된 식물과 동물 물질에서 얻습니다. 일단 원유로 얻어지면 증류라고 불리는 공정은 질량에 따라 다양한 제품을 분리하는 데 사용됩니다. 이 전체 과정을 원유 정제라고합니다.
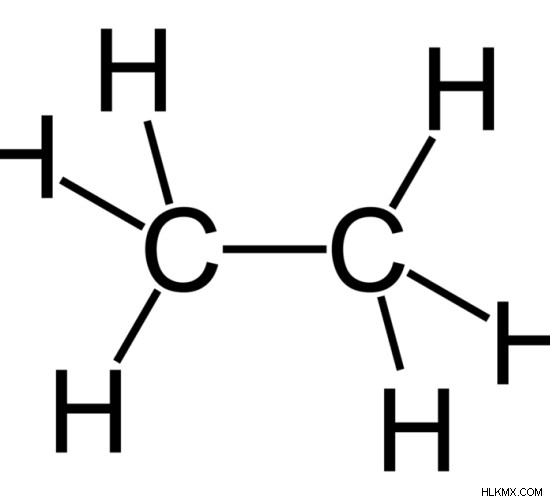
그림 1 :에탄
불포화 탄화수소
불포화 탄화수소는 탄소 사슬 또는 링에 적어도 하나의 탄소 탄소 이중 또는 트리플 결합을 포함하는 탄화수소입니다. 이들 화합물은 포화 탄화수소와 유사한 물리적 특성을 갖는다. 그러나, 그들의 화학적 특성은 주로 다중 결합의 존재로 인해 포화 탄화수소와 크게 다릅니다. 일반적으로 화학 반응은 탄소 사슬에 다수의 결합이 존재하는 위치에서 시작됩니다. 따라서 불포화 탄화수소의 반응성은 주 사슬에 존재하는 다수의 다수의 결합에 의해 증가한다.
불포화 탄화수소의 유형
3 가지 유형의 불포화 탄화수소, 즉 세 가지 유형이 있습니다. (a) alkenes , 하나 이상의 이중 결합 (c =c), (b) alkynes 를 포함하는 것 하나 이상의 트리플 결합 (C≡C) 및 (c) 방향족 탄화수소 가 포함되어 있습니다. , 이는 6 원 탄소 고리를 초래하는 비편성 결합으로 구성됩니다. 알켄의 예는 에텐, 프로 펜, 부틴 등을 포함한다. 아세틸렌, 프로파인, 부티네는 알킨스의 일부 예이다. 벤젠, 톨루엔, 아닐린은 방향족 탄화수소의 일반적인 예입니다. 불포화 탄화수소의 가장 간단한 형태는 에틸렌이며, 과일의 숙성을 유발하는 식물 호르몬으로 중요합니다.
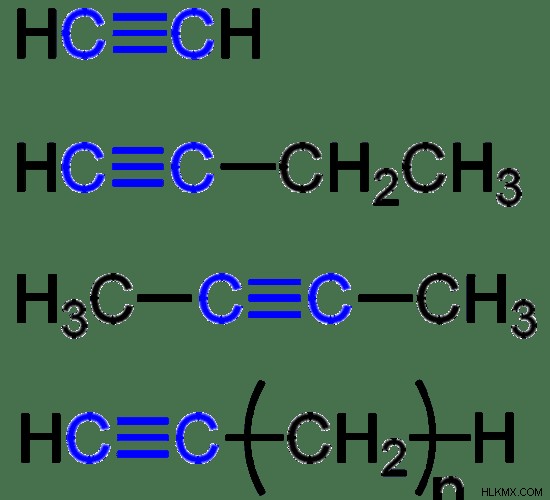
그림 2 :일부 alkynes
포화 된 탄화수소와 불포화 탄화수소의 차이
정의
포화 탄화수소 : 포화 탄화수소는 단일 공유 결합 만있는 탄화수소입니다.
불포화 탄화수소 : 불포화 탄화수소는 다중 공유 결합 (이중 및 삼중 결합)을 갖는 탄화수소입니다.
유형
포화 탄화수소 : 알칸은 포화 탄화수소입니다.
불포화 탄화수소 : Alkenes, Alkynes 및 Aromatic 탄화수소는 불포화 탄화수소의 유형입니다.
반응성
포화 탄화수소 : 포화 탄화수소는 덜 반응성입니다.
불포화 탄화수소 : 불포화 탄화수소는 더 반응성입니다.
공기 중에 화상
포화 탄화수소 : 포화 된 탄화수소를 태우면 파란색, 비 적시 불꽃이 발생합니다.
불포화 탄화수소 : 불포화 탄화수소를 태우면 노란색, 그을음 화염이 발생합니다.
탄소 및 수소 양
포화 탄화수소 : 포화 탄화수소는 탄소가 적고 수소가 적습니다.
불포화 탄화수소 : 불포화 탄화수소는 많은 양의 탄소와 수소가 적습니다
소스
포화 탄화수소 : 이들은 일반적으로 화석화 된 식물과 동물 재료에서 얻습니다.
불포화 탄화수소 : 이들은 주로 식물 (식물 안료, 왁스, 단백질, 식물성 기름 등)에서 얻은 것입니다.
결론
포화 된 탄화수소와 불포화 탄화수소의 차이는 그들이 포함하는 채권의 유형에 따라 다릅니다. 포화 탄화수소는 단일 공유 결합 만 함유하는 반면 불포화 탄화수소는 하나 이상의 이중 또는 트리플 탄소-탄소 결합을 포함합니다. 따라서, 불포화 탄화수소는 포화 탄화수소보다 더 반응성이다. 포화 탄화수소는 알칸을 포함하는 반면 불포화 탄화수소에는 알켄, 알킨 및 방향족 탄화수소가 포함됩니다.
참조 :
1. Cseke, Leland J., Ara Kirakosyan, Peter B. Kaufman, Sara Warber, James A. Duke 및 Harry L. Brielmann. 식물의 천연 제품. Boca Raton, FL :CRC Press, 2006. Print
2. Singh, Lakmir 및 Manjit Kaur. 제 10 수업 과학 2 부 물리학. N.P. :S. Chand, 2016. Print.
3. Stoker, H. Stephen. 일반, 유기 및 생물학적 화학. 제 6 판. N.P. :Cengage Learning, 2012. Print.
이미지 제공 :
1.“Ethane-2d”(Ethane-2d”(공개 도메인) Commons Wikimedia
2.“Alkyne General Formulas V”-Jü의 Alkyne General Formulas V”-Commons Wikimedia