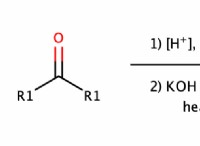
이유는 다음과 같습니다.
* 화학 반응성 : 반응성은 물질이 화학 반응에 얼마나 쉽게 참여하는지를 말합니다. 그것은 다음과 같은 요소에 따라 다릅니다.
* 전자 구성 : 원자에서 전자의 배열은 결합을 형성하는 능력을 결정한다.
* 결합 강도 : 더 강한 결합은 파괴 될 가능성이 적어 반응성이 낮아집니다.
* 기능 그룹의 존재 : 분자 내의 특정 원자 그룹은 반응성에 영향을 줄 수 있습니다.
* 반응성 가스의 예 :
* 산소 (O2) : 연소 및 호흡에 필수적으로 산소는 많은 물질과 쉽게 반응합니다.
* 염소 (Cl2) : 소독제 및 표백제에 사용되는 고도로 반응성 할로겐.
* 이산화 질소 (No2) : 대기 오염 및 산성 비에 기여하는 독성 가스.
* 황화수소 (H2S) : 독특한 썩은 계란 냄새가 나는 가연성 및 부식성 가스.
* 가스 반응성에 영향을 미치는 요인 :
* 온도 : 온도가 높을수록 분자의 운동 에너지가 증가하여 충돌 가능성이 높아져 반응이 촉진됩니다.
* 압력 : 증가 된 압력력은 분자를 더 가깝게하여 더 빈번한 충돌과 잠재적 반응을 초래합니다.
* 촉매의 존재 : 촉매는 활성화 에너지가 낮은 대안 경로를 제공함으로써 반응 속도를 높일 수있다.
결론 :
비 반응성이되는 가스는 일반화입니다. 고귀한 가스와 같은 일부 가스는 안정적인 전자 구성으로 인해 실제로 반응하지 않지만, 다른 많은 사람들은 특정 화학적 특성에 따라 화학 반응에 쉽게 참여합니다.