핵심 개념
이 유기 화학 자습서에서 우리는 정의, 기본 특성, 이름 지정 규칙 및 중요한 반응을 포함하여 에폭 사이드 기능 그룹에 대해 배웁니다.
에폭 사이드 란 무엇입니까?
에폭 사이드는 많은 유기 화합물에서 발견되는 독특한 기능 그룹입니다. 이 그룹에는 3 원 링 구조를 형성하는 2 개의 탄소와 산소가 포함됩니다.
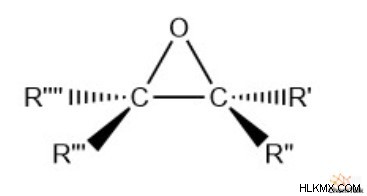
3 원 고리 구조의 특성으로 인해 에폭시드는 안정성이 거의없는 경향이 있습니다. 그러나, 그들은 많은 중요한 유기 합성 경로에서 반응 중간체로서 중요한 사용을 가지고있다.
.에폭 사이드에 대한 빠른 사실
- 구조 :2 개의 탄소와 1 개의 산소의 3 원 링 구조
- 일반 공식 :Coc
- 산도 :매우 산성 (pk a =-3) 양성자 형태 일 때
- 용해도 :물 및 기타 극성 용매에 적당히 가용성
- C-O 결합 길이 :1.47Å
- C-O 본드 엔탈피 :350 kJ mol
- IR 분광법 :에폭시드는 750-880 및 810-950cm에서 2 개의 강한 피크를 나타내는 경향이 있습니다.
에폭 사이드 명명 규칙
다음 섹션에서 볼 수 있듯이, 대부분의 에폭 사이드는 알켄 또는 PI 결합을 가진 다른 종의 유도체로 형성됩니다. 따라서 대부분의 에폭 사이드 명명 규칙에는 부모 알켄에 대한 언급이 포함됩니다.
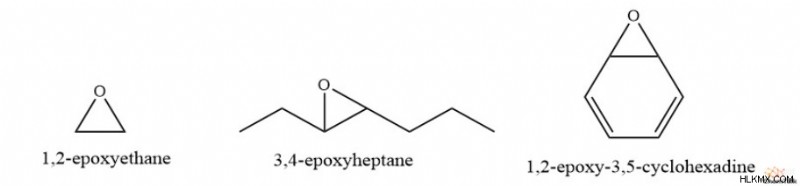
예를 들어, IUPAC 규칙에는 접미사“에폭시-”가있는 두 카본의 수를 인용하는 것이 포함됩니다. 따라서, 가장 간단한 에폭 사이드, c 2 H 4 O, IUPAC 이름은 1,2- 에폭시 에탄입니다. 다른 예로는 3,4- 에폭시 헵탄, 카본 4와 5 사이의 에폭시 그룹과 1,2- 에폭시 -3,5- 사이클로 헥사 디엔이 포함됩니다.
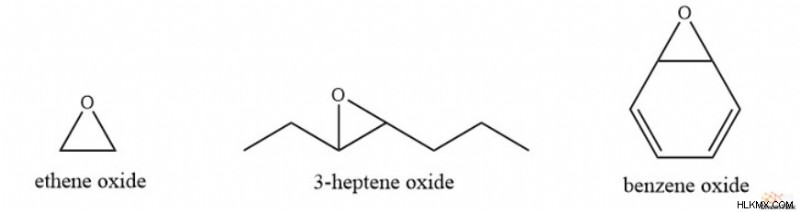
또 다른 일반적인 에폭 사이드 명명 규칙은 단순히 부모 알켄을 명명 한 다음 산화물이라는 용어를 포함하는 것입니다. 따라서, 1,2- 에폭시 에탄은 에덴 옥사이드가되고, 3,4- 에폭시 헵탄은 3-heptene 산화물이되고, 1,2- 에폭시 -3,5- 사이클로 헥사 디엔은 벤젠 옥사이드가된다.
.
에폭 사이드 합성 반응
다음 섹션에서 탐색 할 때, 에폭 사이드에서 많은 합성 적으로 중요한 반응이 발생할 수 있습니다. 결과적으로, 유기 화학자들은 다른 합성 적으로 유용한 다른 그룹으로부터 에폭 사이드를 형성하기위한 많은 기술을 개발했다.
ethene의 산화
옥사이드를 생산하려면 단순히 이성 산소와 반응해야합니다. 중요하게도, 화학자들은은 - 알루미늄 촉매를 사용하여 반응을 자극합니다. 화학량 론적으로, 2 개의 ethenes는 하나의 산소 가스 분자 당 반응합니다. 그러나, 6 개의 분자마다 옥사이드가 하나의 이산화탄소에 하나의 에텐을 완전히 산화시킨다.
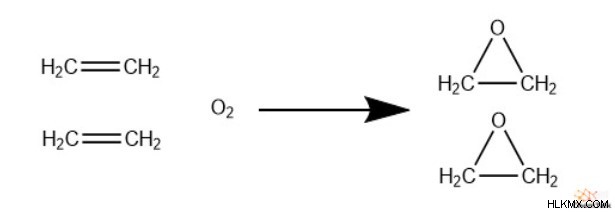
불행하게도, 더 큰 알켄은이 알켄이 반응성이 훨씬 적기 때문에이 메커니즘을 통해 에폭 사이드로 산화 될 수 없다.
과산화물과의 반응
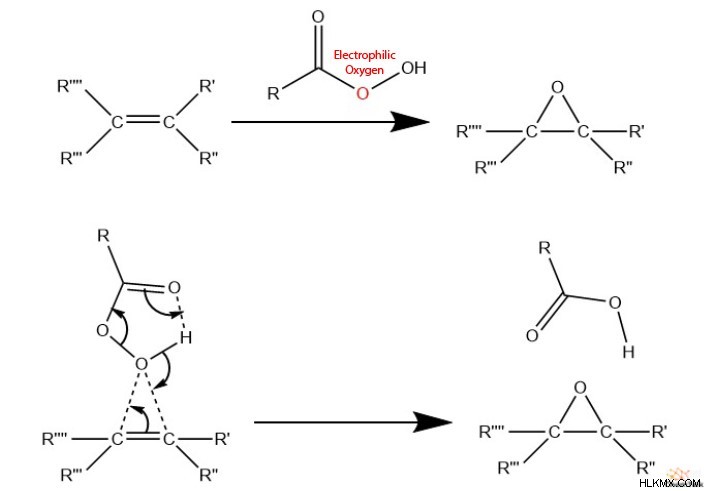
에폭 사이드를 합성하는 또 다른 일반적인 방법은 알켄과 퍼 옥시 카르 복실 산과 퍼 옥시 야신으로도 알려진 반응을 포함한다. 화학자들은 종종이 반응을“올레핀 과산화”라고 부르며,“올레핀”은 알켄의 대체 용어로 사용됩니다. 이들 과산화물 그룹은 알켄의 PI 전자에 의해 공격 될 수있는 전자 성 산소 종을 포함한다. 또한, 퍼 옥시 카르 복실 산은 또한 양성자 수용체로서 작용할 수있는 카르 보닐기를 갖는다.
이 반응은“나비 메커니즘”을 통해 진행되며, 여기에는 8 개의 전자의 공동 이동이 포함되어 에폭 사이드가 발생합니다.
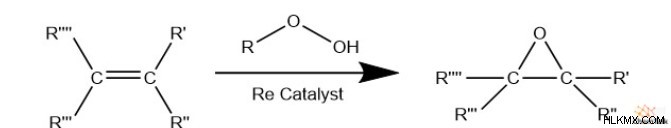
알켄은 또한 일반적인 퍼 옥사이드 (R-OOH)와 반응하여 에폭 사이드를 생성 할 수있다. 그러나,이 반응은 에텐의 산화와 유사한 금속 촉매를 필요로한다. 화학자들은 종종 과산화물과 의이 반응을 "올레핀 산화"라고합니다.
분자 내 S n 2
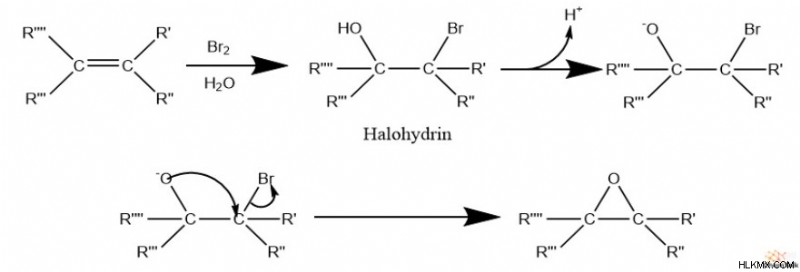
또한, 에폭 사이드는 분자 내 S
다음으로, Halohydrin이 기본 조건에서 존재하면 알코올은 탈 양성자 화되어 산화물을 형성합니다. 마지막으로, 산화물은 할라이드로 탄소를 공격하며, 이는 에폭 사이드가 형성되면서 떠나는 그룹이된다. 이 반응은 분자 내 윌리엄슨 에테르 합성으로 생각 될 수 있습니다.
에폭 사이드와의 반응
친 핵성 첨가
에폭 사이드의 3 원 구조의 고리 균주로 인해 화학자들은 종종 친 핵성 시약을 쉽게 사용하여 고리를 열 수 있습니다. 구체적으로, 친핵체는 탄소 중 하나를 공격하여 탄소의 결합을 준-핵 유화 치환에서“퇴치 그룹”역할을하는 산소와의 결합을 깨뜨린다. 최종 제품에는 불에 해소 된 탄소에 부착 된 알코올 또는 산화물 그룹이 포함됩니다.
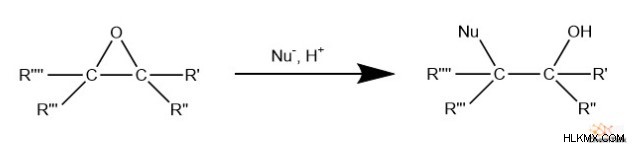
흥미롭게도, 에폭 사이드의 탄소가 상이한 치환기를 갖는 경우,이 반응은 반응 혼합물의 pH에 따라 상영적 일 수있다. 친 핵성 첨가가 기본 조건에서 발생하는 경우, 친 핵성은 입체 방해로 인해 덜 치환 된 탄소를 공격합니다.
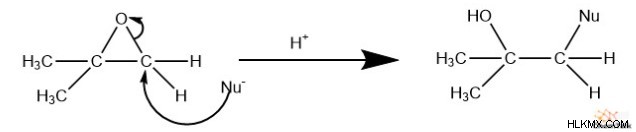
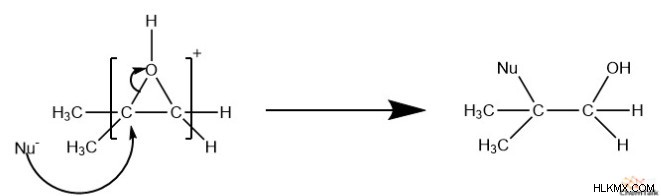
그러나, 반응이 산성 조건 하에서 발생하는 경우, 더 치환 된 탄소는 친핵체와 반응 할 가능성이 높아진다. 이는 에폭 사이드가 반응 전에 양성자 화되기 때문입니다. 결과적으로, 이것은 에폭 사이드의 탄소에 부분 양전하가 발생합니다. 우리가 아는 것처럼 s n 1 반응, 더 치환 된 탄소는 더 안정적인 양이온을 형성합니다. 이것은 산소와 더 치수 탄소 사이의 결합을 약화시켜 파손하기가 더 쉬워집니다.
중합
에폭 사이드 고리가 열리면, 생성 된 알코올은 후속 에폭 사이드 링 개구부에서 효과적인 친핵체로서 작용할 수있다. 결과적으로, 에폭 사이드는 폴리 테이터 구조로 쉽게 중합 할 수있다.
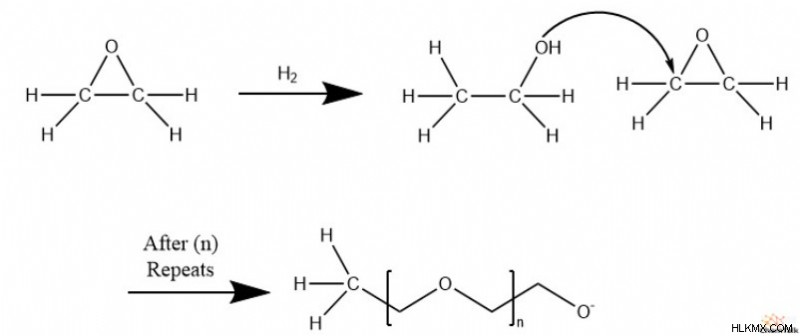
종종, 중합을 촉매하기 위해, 알코올 화합물이 반응에 참여한다. 결과적으로 알코올과 화합물의 R 그룹은 폴리 테이더 체인입니다.
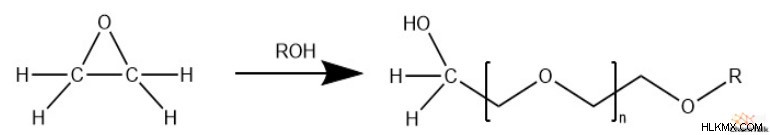
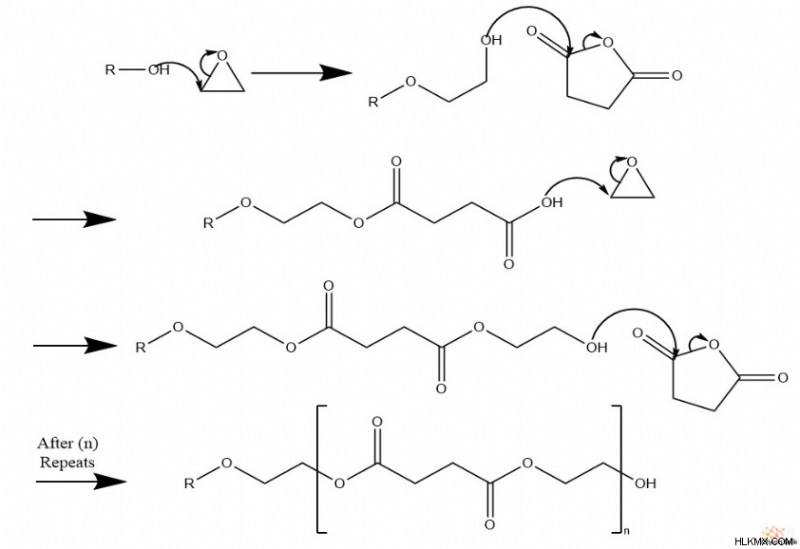
또한 반응 혼합물에 무수물 종이 존재할 때,이 중합 반응은 폴리 에스테르 사슬을 만듭니다.
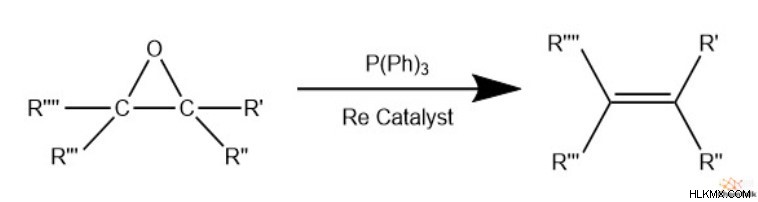
Alkene으로의 축소
고리 열 반응 외에도 화학자는 에폭 사이드를 다시 알켄으로 줄일 수 있습니다. 이것은 종종 텅스텐 또는 레늄과 같은 중금속 촉매뿐만 아니라 수소 가스 (H 2 와 같은 환원제를 포함합니다. ), 트리 페닐 포스페이트 (P (ph)