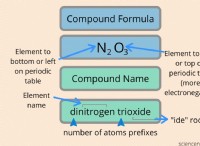
기본 개념 :
* 원자는 물질의 빌딩 블록입니다. 모든 물질은 원자의 화학적 특성을 유지하는 요소의 가장 작은 단위 인 원자로 만들어집니다.
* 화학 반응에서 원자를 생성하거나 파괴 할 수 없습니다. 질량 보존 법칙으로 알려진이 원리는 반응에서 총 원자의 총 수가 일정하게 유지됨을 의미합니다.
* 원자는 특정 비율로 결합하여 분자를 형성합니다. 분자의 조성은 존재하는 원자의 수와 유형에 의해 고정되어 정의된다.
* 화학 반응은 화학 결합의 파손 및 형성을 포함합니다 : 화학적 결합은 분자에서 원자를 함께 유지하며, 이러한 결합은 반응 중에 파손되어 형성 될 수있다.
반응 유형 :
원자 이론을 바탕으로 다양한 유형의 반응을 분류 할 수 있습니다.
* 합성 : 둘 이상의 물질이 결합되어 단일 제품을 형성합니다.
* 예 :2H₂ + OAT → 2H₂O (수소와 산소는 물을 형성하기 위해 반응)
* 분해 : 단일 물질은 둘 이상의 단순한 물질로 분해됩니다.
* 예 :2H₂O → 2H₂ + O₂ (물은 수소와 산소로 분해됩니다)
* 단일 변위 : 한 요소는 화합물의 다른 요소를 대체합니다.
* 예 :Zn + Cuso₄ → ZnSO₄ + Cu (아연은 황산 구리에서 구리를 대체합니다)
* 이중 변위 : 2 개의 새로운 화합물을 형성하는 2 개의 화합물 교환 이온.
* 예 :Agnon + NaCl → Agcl + Nano₃ (질산은 및 염화나트륨 반응하여 염화은 및 질산 나트륨을 형성하기 위해 반응)
* 연소 : 산소와 관련된 빠른 반응, 종종 열과 빛을 생성합니다.
* 예 :Ch 2 + 2o₂ → Co₂ + 2h₂o (메탄은 산소와 반응하여 이산화탄소와 물을 형성합니다)
중요한 고려 사항 :
* 반응 속도 및 조건 : 반응 속도는 온도, 농도, 표면적 및 촉매의 존재를 포함한 다양한 요인에 의존합니다.
* 에너지 변화 : 반응은 에너지를 방출하거나 흡수 할 수 있습니다. 발열 반응은 열을 방출하는 반면 흡열 반응은 열을 흡수합니다.
* 평형 : 많은 반응은 가역적이므로 양방향으로 진행할 수 있습니다. 순방향 및 역 반응의 속도가 동일 할 때 평형에 도달합니다.
요약하면, 원자 이론은 화학 반응의 기본 특성을 이해할 수있게 해줍니다.
* 반응은 원자의 재 배열을 포함합니다.
* 총 원자 수는 일정하게 유지됩니다.
* 화학 결합의 형성 및 파괴는 과정의 중심입니다.
이러한 이해를 통해 새로운 재료 합성에서 새로운 기술 개발에 이르기까지 다양한 목적으로 화학 반응을 예측하고 제어 할 수 있습니다.