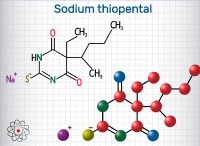
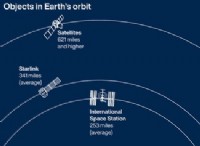
설명 :
용액의 동결 지점 우울증은 용질의 몰에 직접 비례합니다. 몰은 용매 킬로그램 당 용질의 두부 수로 정의된다.
* 클로라이드 칼슘 (CaCl₂)은 세 이온으로 분리됩니다 : Ca²⁻ + 2Cl 2
* 염화나트륨 (NaCl)은 두 이온으로 분리됩니다 : na⁺ + cl⁻
따라서, 동일한 몰 리이트의 경우, 염화칼슘은 염화나트륨과 비교하여 용액에서 더 높은 농도의 이온을 생성 할 것이다. 이 더 높은 농도의 이온은 동결 지점 우울증을 더 크게 이끌어 클로라이드 칼슘의 동결 점을 더 낮게 만듭니다.
다시 말해, 염화칼슘은 염화나트륨보다 물의 동결 지점을 낮추는 데 더 효과적입니다.
동결 지점 :
* 순수한 물 : 0 ° C (32 ° F)
* 염화 칼슘 용액 (20 중량%) : -55 ° C (-67 ° F)
* 염화나트륨 용액 (20 중량%) : -18 ° C (-0.4 ° F)
보시다시피, 같은 농도에서도 클로라이드 칼슘은 염화나트륨에 비해 물의 동결 지점을 상당히 낮 춥니 다.