주요 차이 - 이온화 대 해리
이온화 및 해리는 거의 동일한 의미를 표현하지만 다른 경우에 사용되는 두 가지 관련 용어입니다. 이온화는 다른 유형의 분리를 지칭 할 수 있습니다. 전자의 제거 또는 액체 용액에서 이온의 형성에 의해 원자의 이온화 일 수있다. 반면에, 해리는 분리 된 물질을 원자, 이온 또는 라디칼과 같은 작은 성분으로이다. 이온화와 해리의 주요 차이점은 이온화가 항상 전기 하전 입자를 형성하는 반면 해리는 전기적으로 하전 된 입자를 형성 할 수도 있고 아닐 수도 있다는 것입니다.
주요 영역을 다루었습니다
1. 이온화는 무엇입니까
- 정의, 설명
2. 해리 란?
- 정의, 설명, 해리 상수
3. 이온화와 해리의 차이는 무엇입니까
- 주요 차이점 비교
주요 용어 :원자, 해리, 해리 상수, 전자, 이온 성 화합물, 이온화, 이온화 에너지, 이온 쌍, 방사선, 라디칼

이온화
이온화는 원자 또는 분자가 양수 또는 음전하를 얻는 과정입니다. 이것은 원자 또는 분자로부터 전자를 얻거나 잃어 버리기 때문에 발생하며, 생성 된 이온은 양이온 또는 음이온 일 수있다. 중성 원자 또는 분자로부터의 전자의 손실은 양이온을 형성하고 중성 원자에서 전자의 이득은 음전하를 제공하여 음이온을 형성한다.
원자의 이온화는 원자에서 전자를 제거하여 발생합니다. 에너지를 첨가하여 전자가 중성기 원자에서 제거 될 때, 이는 고유 한 양이온을 형성한다. 이것에 필요한 에너지의 양은 그 원자의 첫 번째 이온화 에너지라고합니다.
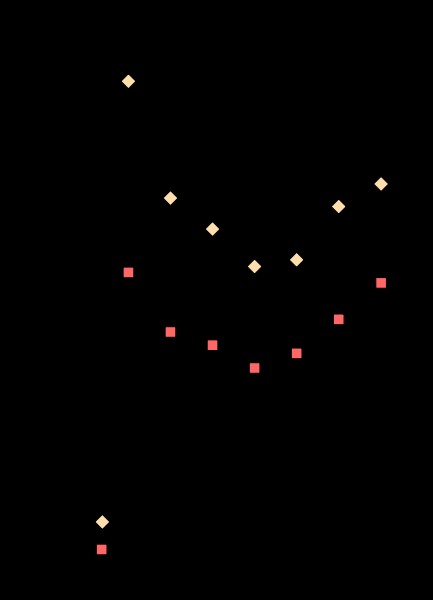
그림 1 :일부 요소의 이온화 에너지
액체 용액에서 발생하는 이온화는 용액에서 이온의 형성입니다. 예를 들어, HCL 분자가 물에 용해 될 때, 히드로 늄 이온 (H 3 o) 형성됩니다. 여기서, HCl은 물 분자와 반응하고 양으로 하전 된 히드로 늄 이온 및 음으로 하전 된 클로라이드 (CL) 이온을 형성한다.
이온화는 충돌에 의해 발생할 수 있습니다. 이것은 전류가 가스를 통과 할 때 주로 가스에서 발생합니다. 전류의 전자가 가스 분자에서 전자를 제거하는 데 필요한 충분한 양의 에너지를 갖는 경우, 가스 분자로부터 전자를 강제하여 개별 양성 이온과 음성 전자로 구성된 이온 쌍을 생성 할 것이다. 여기서는 일부 전자가 전자를 꺼내는 대신 가스 분자에 부착되는 경향이 있기 때문에 음성 이온도 형성 될 수 있습니다.
이온화는 방사선 에너지 또는 충분히 에너지가있는 하전 입자가 고체, 액체 또는 가스를 통과 할 때 발생합니다. 예를 들어, 알파 입자, 베타 입자 및 감마 방사선은 물질을 이온화 할 수 있습니다.
해리 is
화학에서 해리는 물질을 원자, 이온 또는 분자와 같은 작은 입자로 분해하는 것입니다. 이 작은 입자는 일반적으로 주어진 조건에서 함께 재결합 할 수 있습니다. 해리는 원자, 이온 또는 라디칼을 형성하여 발생할 수 있습니다.
해리의 주요 원인은 용매의 추가 및 열 형태의 에너지를 추가하는 것입니다. 이온 성 화합물이 물에 용해 될 때, 이온 성분에 해산된다. NaCl이 물에 용해되면 생성 된 용액에는 NA 양이온 및 CL 음이온이 포함되어 있습니다.

그림 2 :아세틸 살리실산 해리
해리 상수
해리 상수는 제품의 농도와 해리 후 반응물 농도 사이의 비율입니다. 온도가 일정하면 일정한 값이 있습니다. 예를 들어 물을 고려해 봅시다.
h 2 o/H +OH
그 후 물의 해리 상수는
입니다kw =[h] [OH] / [h 2 영형]
이온화와 해리의 차이
정의
이온화 : 이온화는 원자 또는 분자가 양수 또는 음전하를 얻는 과정입니다.
해리 : 해리는 물질을 원자, 이온 또는 분자와 같은 작은 입자로 분해하는 것입니다.
개념
이온화 : 이온화는 이온의 형성이다.
해리 : 해리는 더 큰 화합물로부터의 작은 성분의 형성이다.
이론
이온화 : 이온화는 원자 또는 분자가 전자 (또는 전자 소수)를 얻거나 잃을 때 발생합니다.
해리 : 해리는 용매를 첨가하고 열 형태의 에너지를 첨가하여 발생합니다.
최종 제품
이온화 : 이온화는 항상 결국 이온을 형성합니다.
해리 : 해리는 출발 물질보다 작은 원자, 이온 또는 분자를 형성합니다.
결론
이온화 및 해리는 기본적으로 동일한 이론을 표현합니다 :구성 요소의 분리. 이온화와 해리의 주요 차이점은 이온화가 항상 전기 하전 입자를 형성하는 반면 해리는 전기적으로 하전 된 입자를 형성 할 수도 있고 아닐 수 있다는 것입니다.
참조 :
1.“이온화.” Encyclopædia Britannica, Encyclopædia Britannica, Inc., 2016 년 10 월 17 일.
2. "분리." Encyclopædia Britannica, Encyclopædia Britannica, Inc., 2011 년 12 월 7 일.
3. "해리 상수." Wikipedia, Wikimedia Foundation, 2018 년 1 월 22 일, 여기에서 구입할 수 있습니다.
이미지 제공 :
1.“알칼리 금속 및 알칼리성 지구 금속의 이온화 에너지”Depiep-Commons Wikimedia
2를 통한 자체 작업 (CC By-SA 3.0). Fvasconcellos의 "아세틸 살리실산 분리", 2007 년 9 월 7 일, 2007 년 9 월 7 일 (UTC)-이미지 후의 작업 :ASA 산 해리 342.jpg (CC BY-SA 3.0)를 통한 Commons Wikimedia