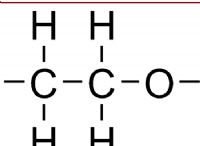
1. 붕소의 빈 p- 궤도 :
* BH3의 붕소는 3 개의 원자가 전자 를 가지고 있습니다 수소 원자와 3 개의 결합을 형성합니다. 이것은 빈 p- 궤도를 남긴다 붕소 원자에.
*이 빈 p- 궤도는 전자 결핍 입니다 전자를 쉽게 받아들입니다.
2. 수소 브리징 :
* 하나의 BH3 분자에서 붕소의 빈 p- 궤도는 다른 BH3 분자에서 수소 원자의 채워진 1s 궤도와 겹칠 수 있습니다.
* 이것은 수소 교량 를 만듭니다 두 붕소 원자 사이의 (또는 3- 센터 2- 전자 결합) 이량 체화 및 추가 중합을 초래한다.
3. 메탄에서도 비슷한 기회 부족 :
* 메탄 (CH4)에서, 탄소 원자는 4 개의 원자가 전자 를 갖는다. 수소 원자와 4 개의 공유 결합을 형성합니다.
* 빈 궤도가 없습니다 전자를 수용하기 위해 탄소에서 이용 가능하여 수소 브리징이 불가능합니다.
* 또한 탄소는 붕소보다 다기관 결합을 형성 할 가능성이 훨씬 적습니다.
요약 :
* BH3의 빈 P- 궤도와 수소 다리를 형성하는 능력은 중합으로 이어진다.
* CH4에는 이러한 특성이 부족하므로 단량체로 남아 있습니다.
추가로 :
* 중합 된 BH3의 중합 형태를 디보 레인 (B2H6)이라고한다.
* Diborane은 강력한 환원제이며 다양한 산업 공정에서 사용됩니다.
이 설명이 도움이되기를 바랍니다! 더 이상 질문이 있으면 알려주세요.