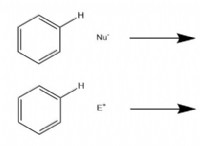
다음은 고장입니다.
* 전방 반응 : 반응물이 생성물로 전환되는 반응.
* 역 반응 : 생성물이 반응물로 다시 전환되는 반응.
* 평형 : 순방향 및 역 반응 속도가 동일 한 상태.
평형에 대한 중요한 점 :
* 동적 프로세스 : 농도가 일정하게 보이지만, 전방 반응과 역 반응은 여전히 동일한 속도로 발생하고 있습니다. 정적 균형이 아니라 역동적 인 균형입니다.
* 반드시 동일한 농도는 아닙니다 : 평형이 반드시 반응물과 생성물이 동일한 양으로 존재 함을 의미하지는 않습니다. 평형 위치는 반응물 또는 생성물을 선호 할 수 있습니다.
* 평형 변화 : 온도, 압력 또는 농도와 같은 조건의 변화에 의해 평형을 파괴 할 수 있습니다. 이런 일이 발생하면 시스템이 평형을 다시 확립하기 위해 이동합니다.
비유 :
수도꼭지에서 물이 흐르고 배수구를 통해 물이 배수되는 욕조를 상상해보십시오. 욕조의 수위가 일정하게 유지되면, 흐르는 물이 흐르는 물과 동일하다는 것을 의미합니다. 이것은 화학 반응에서 평형과 유사합니다.
요약 :
평형은 순방향 반응 및 역 반응의 속도가 동일하여 시간이 지남에 따라 농도의 순 변화를 초래하는 가역적 반응에서 균형 상태입니다. 반응이 여전히 발생하지만 동일한 속도로 동적 프로세스입니다.