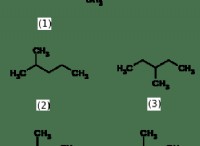
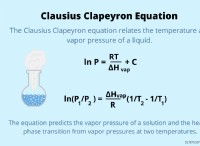
1. 전해질 : 바닷물은 전해질로서 작용하며, 이는 전기를 전도 할 수있는 용해 된 이온을 함유한다는 것을 의미한다.
2. 전해 세포의 형성 :
* 양극 : 철 (Fe)은 산화가 발생하는 양극으로 작용합니다.
* 음극 : 탄소와 같은 철의 불순물은 감소가 발생하는 캐소드 역할을합니다.
* 전해질 : 바닷물은 이온 운동을위한 매체를 제공합니다.
3. 양극의 산화 : 철 원자가 전자를 잃고 철 (II) 이온 (Fe²⁺)을 형성합니다.
* Fe (s) → fe²⁺ (aq) + 2e⁻
4. 음극에서의 감소 : 물의 산소가 감소하여 전자를 얻습니다.
* o 4 (g) + 4h⁺ (aq) + 4e⁻ → 2h₂o (l)
5. 녹 형성 : 철 (II) 이온은 물로부터 수산화물 이온 (OHA)과 반응하여 철 (II) 수산화물 (Fe (OH) ₂)를 형성합니다.
* fe²⁺ (aq) + 2oh⁻ (aq) → Fe (OH) ₂ (S)
철 (II) 수산화물은 산소 및 물의 존재 하에서 불안정하며, 일반적으로 Rust 로 알려진 수화 된 철 (III) 산화철 (III)을 형성하도록 추가로 산화된다. (fe xo· · xh₂o).
녹슬가 가속화하는 요인 :
* 소금의 존재 : 소금은 더 많은 이온을 제공하여 전해질의 전도도를 증가시킵니다.
* 온도 : 온도가 높을수록 화학 반응 속도가 증가합니다.
* 산소 : 산소는 녹 형성에 필수적입니다.
* 산도 : 산성 조건 (낮은 pH)은 부식 과정의 속도를 높입니다.
녹 방지 :
* 코팅 : 페인트, 오일 또는 그리스와 같은 보호 코팅을 적용하면 철과 환경 사이에 장벽이 생깁니다.
* 아연 도금 : 희생 양극으로 작용하는 아연 층으로 철을 코팅하면 철을 부식으로부터 보호합니다.
* 합금 : 스테인레스 스틸과 같은 합금을 형성하기 위해 다른 금속을 철에 추가하면 부식에 대한 저항이 증가합니다.