주요 차이-헥산 대 N- 헥산
헥산 및 n- 헥산은 알칸 카테고리에 포함 된 유기 화합물입니다. 그것들은 포화 탄화수소이며 모든 원자 사이에 단일 결합 만 포함합니다. 헥산 및 N- 헥산은 또한 지방족 화합물이다. 이것은 이것이 링 구조가 아니라는 것을 의미합니다. 이 화합물은 휘발유의 중요한 성분입니다. 따라서, 헥산 화합물의 주요 공급원은 가솔린이다. 이것들은 비교적 작은 탄화수소이므로 쉽게 증발합니다. n- 헥산은 선형 형태의 헥산이다. 헥산은 화학적 공식 C 6 를 갖는 분지 및 균형 잡힌 분자의 혼합물입니다. h 14 . 헥산과 N- 헥산의 주요 차이점은 헥산은 분지 또는 브랜치가없는 5 개의 구조 이성질체를 가지지 만 N- 헥산은 구조되지 않은 구조입니다.
주요 영역을 다루었습니다
1. 헥산
- 정의, 구조, 특성 및 반응
2. n- 헥산
란? - 정의, 구조, 특성 및 반응
3. 헥산과 n- 헥산의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. 헥산과 n- 헥산의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :지방족, 알칸, 가솔린, 헥산, 탄화수소, n- 헥산, 파라핀 분획, 구조 이성질체
헥산
헥산은 화학식 c 6 를 갖는 탄화수소입니다. h 14 . 이 화학적 공식은 5 개의 주요 구조 이성질체에서 발생할 수 있습니다. 이들 이성질체는 헥산 화합물이다. 헥산의 몰 질량은 86.18 g/mol입니다. 그것은 무색 액체이며 강한 냄새가납니다.
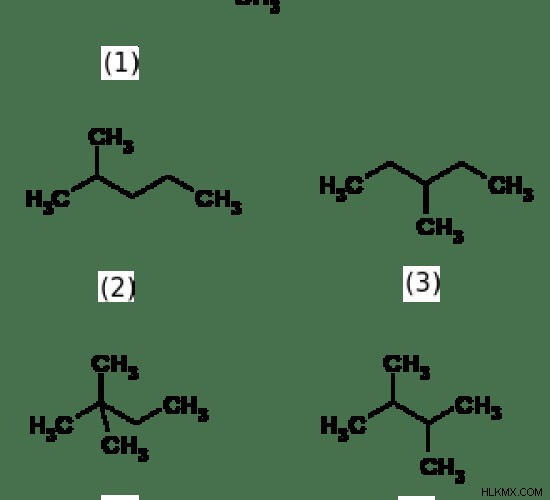
그림 1 :5 헥산의 구조 이성질체
위의 이미지는 헥산의 5 개의 구조 이성질체를 보여줍니다. 그들의 공통 이름은 –Hexane으로 끝나지 만,이 화합물의 IUPAC 이름은 서로 다릅니다. 위 분자의 공통 이름과 IUPAC 이름은 다음과 같습니다.
|
분자
|
공통 이름
|
IUPAC 이름
|
|
(1)
|
n- 헥산
|
헥산
|
|
(2)
|
이소 헥산
|
2- 메디펜탄
|
|
(3)
|
이소 헥산
|
3- 메틸 펜타 인
|
|
(4)
|
네오 헥산
|
2,2- 디메탈 부탄
|
|
(5)
|
이소 헥산
|
2,3- 디메틸 부탄
|
이것들은 다른 구조이기 때문에이 분자는 다른 용융점과 비등점을 갖습니다. 그러나이 모든 것은 무색 화합물입니다. 이것은 작은 알칸이기 때문입니다.
헥산은 비교적 덜 반응성입니다. 따라서 그것은 다른 화합물에 대한 좋은 용매 역할을합니다. 비극성이므로 헥산 화합물은 물에 용해되지 않습니다.
n- 헥산
n- 헥산은 화학식 c 6 를 갖는 지방족 탄화수소입니다. h 14 . 알칸입니다. 따라서 강한 냄새가 나는 무색 화합물입니다. N- 헥산의 몰 질량은 약 86.18 g/mol입니다. 선형 또는 직선 체인 탄화수소 형태의 헥산입니다. 비극성 화합물입니다. 따라서 물이나 다른 극성 용매에 용해되지 않습니다. 반응성 화합물의 용매로 사용될 수 있습니다.
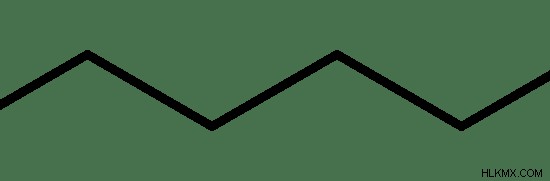
그림 2 :n- 헥산 구조
n- 헥산의 IUPAC 이름은 헥산입니다. N- 헥산의 용융점은 약 -95C입니다. N- 헥산의 끓는점은 69C로 제공됩니다. 끓는점은 상당히 높은 값이므로 N- 헥산은 표준 온도 및 압력 조건에서 액체 물질입니다.
n- 헥산은 휘발성이 높은 탄화수소로 간주됩니다. 원유 정제의 파라핀 분획에서 구성 요소로 발견 될 수 있습니다. NFPA (National Fire Protection Association)에 따르면 N- 헥산은 약간 독성이 높은 가연성 화합물입니다. N- 헥산은 액체 염소와 같은 고도로 산화제와 격렬하게 반응합니다. 섬유 산업, 인쇄 및 가구 제조에서 청소제로 사용될 수 있습니다.
헥산과 n- 헥산 간의 유사성
- 헥산과 N- 헥산 둘 다의 화학적 공식은 C 6 입니다. h 14 .
- 두 화합물은 실온 및 압력에서 액체입니다.
- n- 헥산은 헥산의 구조적 이성질체입니다.
- 둘 다 지방족 탄화수소입니다.
- 헥산 화합물의 몰 질량은 서로와 N- 헥산과 같습니다.
헥산과 n- 헥산의 차이
정의
헥산 : 헥산은 화학식 C 6 을 갖는 탄화수소입니다 h 14 .
n- 헥산 : N- 헥산은 화학적 공식 C 6 를 갖는 지방족 탄화수소이다. h 14 .
구조
헥산 : 헥산 화합물은 분지 또는 방지 분자 일 수 있습니다.
n- 헥산 : N- 헥산은 브랜치 분자입니다.
이성질체
헥산 : 헥산은 5 개의 주요 구조 이성질체에서 찾을 수 있습니다.
n- 헥산 : n- 헥산은 이성질체가 없다.
비등점
헥산 : 헥산 분자의 끓는점은 이성질체마다 다릅니다.
n- 헥산 : N- 헥산의 끓는점은 다른 헥산 화합물의 끓는점보다 높습니다.
결론
헥산은 5 개의 주요 구조 이성질체에서 찾을 수 있습니다. N- 헥산은 또한 헥산의 구조적 이성질체이다. 따라서, 이들 화합물은 동일한 화학적 공식과 동일한 몰 질량을 갖는다. 헥산과 N- 헥산의 주요 차이점은 헥산이 분지 또는 브랜치 구조의 5 개의 구조 이성질체를 가지지 만 N- 헥산은 브랜치 구조라는 것입니다.