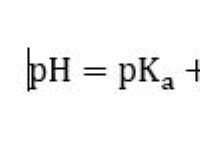다음은 고장입니다.
* 기화 열 : 이는 끓는점에서 특정 양의 액체를 증발시키는 데 필요한 열 에너지의 양을 나타냅니다. 일반적으로 두더지 당 줄 (J/mol) 또는 그램 당 칼로리 (cal/g)로 표현됩니다.
* 기화의 엔탈피 : 이것은 위상에서 액체에서 가스로 전이하는 동안 엔탈피 (시스템의 총 에너지를 나타내는 열역학적 특성)의 변화를 나타내는보다 정확한 용어입니다. 또한 두더지 당 줄 또는 그램 당 칼로리 단위로 표현됩니다.
기화 열에 영향을 미치는 요인 :
* 분자간 힘 : 더 강한 분자간 힘 (수소 결합과 같은)은 극복하기 위해 더 많은 에너지가 필요하여 기화가 더 높아집니다.
* 분자량 : 더 큰 분자는 일반적으로 더 강한 반 데르 (Van der Waals) 힘으로 인해 더 높은 기화 열이 있습니다.
* 온도 : 기화 열은 온도가 증가함에 따라 약간 감소합니다.
예 :
물의 기화 열은 끓는점에서 40.7 kJ/mol입니다. 이것은 100 ° C에서 1 몰의 물을 증발시키기 위해 40.7 kJ의 에너지가 필요하다는 것을 의미합니다.