기본 모델 :"태양계"유추
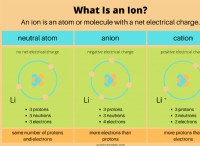
* 핵 : Atom의 중심 코어는 다음을 포함합니다.
* 양성자 : 양으로 하전 된 입자.
* 중성자 : 중립적으로 하전 된 입자.
* 강한 힘 : 이 강력한 힘은 핵에서 양성자와 중성자를 함께 유지합니다.
* 전자 구름 : 핵을 둘러싼 전자 구름은 전자, 음으로 하전 된 입자가 존재하는 공간의 영역입니다. 단단한 구체가 아닙니다. 전자가 발견 될 가능성이 높은 흐릿한 영역으로 생각하십시오.
키 포인트
* 대부분의 원자 덩어리는 핵에 집중되어 있습니다. 양성자와 중성자는 전자보다 질량이 훨씬 큽니다.
* 원자는 대부분 빈 공간입니다. 전자는 작고 방대한 거리에서 핵을 공전하므로 원자의 대부분은 빈 공간입니다.
* 전자 구름은 고정 배열이 아닙니다. 전자는 복잡하고 예측할 수없는 방식으로 핵 주위를 움직입니다. 우리는 orbitals 를 사용합니다 전자가 발견 될 가능성이 가장 높은 영역을 설명합니다.
더 세부적으로 전자 구름
* 궤도 : 핵 주위에 일련의 "껍질"또는 "에너지 수준"을 상상해보십시오. 각 쉘은 특정 수의 전자를 담을 수 있습니다.
* 쉘 1 : 핵에 가장 가까운 껍질은 최대 2 개의 전자를 담을 수 있습니다.
* 쉘 2 : 최대 8 개의 전자를 수용 할 수 있습니다.
* 쉘 3 : 최대 18 개의 전자를 수용 할 수 있습니다.
* 서브 쉘 : 각 쉘 안에는 서브 쉘이 있습니다. 각 서브 쉘은 특정 위치에서 특정 위치에서 전자를 찾을 확률을 결정하는 특정 모양을 갖습니다.
* 전자 구성 : 쉘 및 서브 쉘 내의 전자의 특정 배열을 전자 구성이라고합니다. 이 구성은 원자의 화학적 특성을 지시합니다.
키 테이크 아웃
* 원자는 엄청나게 작고 복잡합니다.
* 양성자, 중성자 및 전자의 배열은 요소의 화학적 거동을 결정합니다.
* 전자 구름은 단순한 구체가 아니라 전자를 찾기위한 확률 분포가있는 공간 영역입니다.
추가 탐사
원자 구조에 대해 더 깊이 파고 들기를 원한다면 다음을 탐색 할 수 있습니다.
* 양자 역학 : 이 물리학은 전자 및 다른 아 원자 입자의 거동을 설명합니다.
* 원자 모델 : 역사 전반에 걸쳐 원자의 여러 모델이 있었으며, 각각의 구조에 대한 이해를 향상시켰다.
* 전자 구성 : 껍질과 서브 쉘에 전자가 어떻게 배열되는지 이해하는 것은 화학 결합 및 반응을 이해하는 데 중요합니다.