암모니아 의 공식적인 화학 전하 (NH3)은 0이므로 실제로 화학 전하가 없습니다 . 말하기는 쉽지만, 그 대답을 맥락에 배치하고 화학의 의미를 이해하는 것이 중요합니다. 을 계산하는 방법을 아는 것도 중요합니다 원자의 전하
공식 요금을 계산하는 방법과 그 의미를 살펴 보겠습니다.
요금이란?
화학 물질이 서로 어떻게 반응하는지 결정하는 데 가장 중요한 요소 중 하나는 원자 사이에 존재하는 전자 결합입니다. 전자는 원자의 핵을 공전하고 음으로 하전됩니다. 모든 원자의 전자 쉘에는 정의 된 수의 전자가 있으며, 원자는 원자의 순 전하가 불균형임을 의미 하더라도이 전자 수를 유지하려고합니다. 원자에는 또한 개별 전하가 동일한 양성자가 있습니다.
원자의 전하는 일반적으로 요소의 오른쪽에있는 숫자로 표현됩니다 :NA1+. 원자의 전하를 나타내는 1+를 전하 번호라고도합니다.
원자는 여러 껍질로 구성되며 각 쉘은 약간 다른 수의 전자를 가지고 있습니다. 가장 안쪽 쉘에는 일반적으로 2 개의 전자가 있고, 두 번째 쉘은 8 개를 유지할 수 있으며, 세 번째 쉘은 최대 18 개의 전자를 유지할 수 있습니다. 원자의 외부 껍질을 구성하는 전자는 집합 적으로 원자가 쉘이라고합니다. 원자가 껍질은 원자 사이의 화학 반응이 발생하는 곳입니다. 원자의 전하 번호는 원자의 원자가 쉘이 일반적으로 전자 세트 세트를 가질 것이라는 사실을 반영합니다.
요소의 주기성 테이블
주기적인 원소 표는 요소의 원자가 화학 반응에 사용할 수있는 전자의 수에 의해 요소를 그룹화합니다.
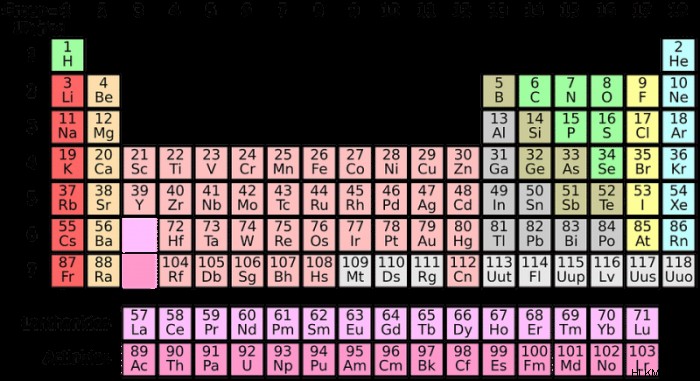
주기율표, 열 I 및 II의 왼쪽 부분에서 발견되는 요소에는 효과적으로 비어있는 원자가 껍질이 있습니다. 그들은 하나 또는 두 개의 전자 만 가지고 있으며 주로 금속 - 알칼리 금속과 알칼리성 지구 금속입니다. 이것에 대한 예외는 수소이며, 이는 규조토가 아닌 비금속입니다. 주기 테이블의 3 ~ 7 열은 비금속이며, 각각 반응을위한 3-4 개의 전자가 있습니다. 다른 요소와 반응 할 수없는 요소도 있습니다. 이것들을 고귀한 가스라고하며 이미 전체 원자가 껍질이 있습니다. 여기에는 크세논과 라돈이 포함됩니다.
요소의 전하 번호는 화학 반응 동안 다른 원자와 반응 할 때 원자가 소유하는 전하의 종류를 파악하는 데 사용될 수 있습니다. 원자가 전자를 잃거나 얻는 지에 따라 양전하 또는 음전하가 발생할 수 있습니다. 예를 들어, 염소와 나트륨의 상호 작용을 살펴 보겠습니다. 염소 원자는 나트륨과 반응하면 하나의 전자를 얻는 반면, 나트륨은 전자를 잃게됩니다. 이것은 각각 Cl1+와 Na1-를 만듭니다.
변경되지 않은 형태에서 모든 요소의 충전 번호는 0입니다. 그들은 다른 원자와 반응하지 않았기 때문에 전자를 잃거나 얻지 못했기 때문입니다.
암모니아의 특성
이제 우리는 암모니아의 화학적 구조를보고 그것이 왜 충전이 없는지 이해하기 시작할 수 있습니다.
암모니아는 수소와 질소 원자로 만들어진 화합물입니다. 눈에 띄는 매운 냄새가 나는 무색 가스입니다. 그것은 집중된 형태로 위험하고 가성 일 수 있으며 청소 용액 및 비료에 자주 사용됩니다.
암모니아의 정확한 화학적 공식은 nh 3 입니다 . 이것은 1 개의 질소 원자와 3 개의 수소 원자로 만들어졌으며 피라미드 형태로 배열되어 있음을 의미합니다. 질소는 고독한 전자 쌍을 가지고 있으며, 이는 원자를 수소 (H+)로 기증 할 수 있습니다. 본드는 완전한 이온 결합이 아니라 공유 결합입니다. 이것은 고독한 쌍이 극성 분자의 음의 끝임을 의미합니다. 따라서 질소 쌍은 분자의 다른 쪽 끝에서 부분 양전하로 균형을 이루는 부분 음전하를 가지고 있습니다.
고독한 전자 쌍은 nh 3 일 때 분할 될 수 있습니다. Atom은 수소 양성자를 받아 NH4+ (암모늄)가됩니다. 그러나 이것이 일어날 때까지, 고독한 쌍의 존재는 nh 3 의 원자를 만듭니다. 전하가 0 인 중성 분자. 이것이 왜 그런지 확인하기 위해 원자의 공식 전하를 계산할 수 있습니다.
공식 전하 계산
원자의 공식 전하를 계산하는 것은 전자 회계 방법입니다. 원자의 공식 전하를 계산할 때 화학적 결합의 전자가 원자에 걸쳐 동일하게 분포되어 있다고 가정합니다.
원자의 공식 전하를 결정하기위한 방정식은 다음과 같습니다.
- 공식 전하 =[원자의 원자가 전자 수]-[(결합 전자 수) + (본드 수)].
대안 적으로,이 공식은 결합 전자와 고독한 전자의 전자 사이의 관계를 조금 더 명시 적으로 만듭니다.
- 공식 전하 =[원자가 전자 수] - [(고독한 쌍의 전자 수) + (본딩 전자의 절반)
어떤 방정식을 사용하든 공통 요소 전하를 사용하여 방정식을 수행 할 수 있습니다. 공통 요소 요금 테이블에 컨설팅하면 수소는 +1의 전하가 있고 질소는 -3입니다.
수술을 수행하면 암모니아의 총 요금이 부과됩니다.
총 전하 =5 (원자가 전자 수)-[3 (수소에 대한 본드) + 2 (론 전자) =0
따라서 암모니아의 원자는 전반적인 전하가 0입니다. 중립 전하.
공통 요소 전하에 주어진 값은 전자 쉘의 가장 일반적인 배열 만 반영합니다. 가장 일반적인 배열은 가장 안정성이 가장 높은 배열입니다. 이러한 안정적인 배열이 가장 가능성이 높지만 다른 요금이 나타날 수 있습니다. 앞서 언급 한 고귀한 가스는 원자가 껍질에 전자의 변이가없는 유일한 원자입니다. 이미 외부 껍질에서 8 개의 전자를 찾을 수 있습니다.