물이 극지 분자라고 들었을 수도 있지만 이산화탄소 는 어떻습니까? ? Polar 입니까? 또는 비극성 ? 이산화탄소는 비극성 분자로 간주됩니다. 대칭 구조가 있기 때문에, 탄소의 전자 밀도를 정확히 동일한 방식으로 바꾸는 산소의 두 원자와 함께 대칭 구조를 갖기 때문입니다. 이산화탄소의 비극성에 대한 짧은 대답입니다.
그러나 다른 극성 분자와 이산화탄소의 비극성 속성을 맥락화하고 분자의 극성이 어떻게 결정되는지에 대해 자세히 설명하는 것이 좋습니다.
CO2와 관련된 극성의 정의
극성 분자는 양전하 및 음전하의 영역/영역을 갖는 분자입니다. 그들은 지구의 반대 기둥과 마찬가지로“극”을 가지고 있거나 배터리의 양 및 부정적인 끝과 같습니다. 따라서 분자의 양성 및 부정적인 영역이 있다면 분자는 극성이라고합니다 - 극성을 갖는다.
극성 분자의 가장 유명한 예 중 하나는 물입니다. 물은 그것에 구부러진 구조를 가지고 있으며 산소 원자에 부착 된 2 개의 수소 원자는 약간의 양전하를 갖는다. 한편, 원자의 다른 쪽 끝 (산소 분자)은 약간의 음전하가 있으며이 두 전하는 물의 극성을 제공합니다.
당신이 추측 할 수 있듯이, 뚜렷한 양의 영역과 부정적인 영역이없는 분자는 단지 "비극성"이라고합니다. 비극성 분자의 예는 에탄 - 화학적 공식 C2H6입니다. 에탄은 두 가지 다른 이유로 비극성 분자입니다. 분자의 대칭 구조는 분자가 전기 음성의 균일 한 확산을 유지하는 데 도움이되므로 탄소의 두 원자 사이의 전기 음성량의 양에는 차이가 없으며 수소 원자와 탄소 원자 사이의 전기 음성의 차이는 거의 없습니다. 에탄의 대칭 적 특성은 그것이 비극성이 될 것이라고 보장하지는 않지만, 지역에 주목할만한 충전이 없음을 유지하는 데 도움이됩니다. 대부분의 알칼리성은 비슷한 구조를 공유 할 것이며, 이것이 알칼리성 요소가 일반적으로 비극성이라고하는 이유 중 하나입니다.
화학에는“좋아하는 것처럼”이라는 개념이 있으며, 이는 분자의 용해도가 비슷한 물질에있을 때 더 큽니다. 비극성 화학 물질은 함께 결합하면 더 쉽게 용해되며 이것은 극학 화학 물질에도 적용됩니다.
지역은 어떻게 긍정적이고 부정적인가?
분자의 극성은 전자의 이동으로 인해 발생합니다. 전자는 특정 방향으로 이동하여 분자 영역의 양수/음성 균형에 영향을 미칩니다. 이들 전자 이동 방법은 결합이 전자를 함유하고 극성을 가질 수 있기 때문에 분자 사이에서 발견되는 결합에 의존한다.
결합을 형성하는 두 원자가 다르면, 원자 사이의 결합은 극성으로 분류됩니다. 결합을 형성하는 두 가지 다른 원자는 원자의 핵이 결합에서 전자를 끌어들이는 능력이 다른 능력을 갖고 전자의 위치가 변할 것임을 의미합니다. 동일한 유형의 원자를 포함하는 결합은 비극성이 아니며 두 원자의 핵이 가지고있는 전자에 단단히 달라 붙기 때문에 결합 내의 전자가 이동하는 것을 허용하지 않습니다.
이 모든 것은 전자를 그 자체로 끌어 올리는 능력이 더 큰 원자가 주변의 전자 수가 많기 때문에 약간 더 부정적이 될 것임을 의미합니다. 이것은 부정적인 영역과 양성 영역을 만들고 본질적으로 결합을 극성으로 만듭니다. 이것에 대해 생각하는 또 다른 방법은 극지 결합의 일부인 전자가 본드의 한쪽 끝이나 다른 쪽 끝을 향해 모일 것입니다. 이것은 채권 중 하나가 약간의 양전하를 가질 것이며 채권의 다른 쪽 끝은 본질적으로 약간 부정적 인 전하를 가질 것임을 의미합니다.
왜 이산화탄소 극지가 아닌가?

극/비극성 결합의 주목할만한 측면 중 하나는 두 원자 사이의 전기 음성 차이가 클수록 두 분자 사이의 결합이 더 많을 것입니다. 예를 들어, 카르 보닐기 내의 탄소는 약간의 양전하를 가지며, 이는 카르 보닐 화합물이 양성 영역을 갖는다. 전자 결합과의 비극성/극성 관계의 이러한 측면을 감안할 때, 왜 부분적으로 음의 산소 원자를 갖는 이산화탄소가 극성 특성을 갖는가?
분자 내의 모든 결합은 분자의 극성을 결정할 때 고려되어야한다. 이산화탄소 내 결합의 순 효과를 살펴보면 분자가 왜 비극성 분자인지 알 수 있습니다.
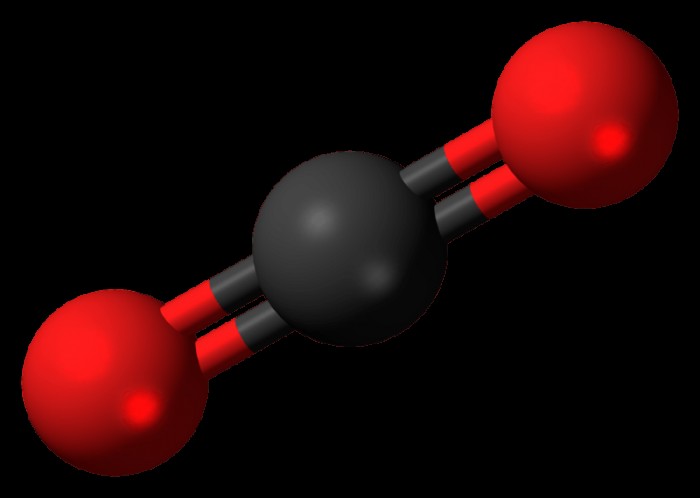
이산화탄소의 화학적 공식은 CO2이고 분자의 결합은 다음과 같이 표현 될 수 있습니다.
o =C =O
이산화탄소 다이어그램을 볼 때 명백한 바와 같이, 중간의 탄소 원자는 산소를 갖는 2 개의 결합을 가지며, 각각은 이들 결합이 이중 결합이다. 산소가 탄소보다 더 큰 전기 음성 강도를 갖는 것이 사실이기 때문에, 산소와 탄소 사이의 결합은 전자가 산소를 향해 당겨지고 분자가 극성이되는 것을 보게 될 것이라고 생각할 것입니다.
.그러나 분자의 구조로 인해 비극성 상태를 유지합니다. 분자는 두 이중 결합이 중심의 탄소 원자에 180도 각도로 탄소 분자와 선형 배열에 있도록 구성됩니다. 이 선형 구조는 산소 원자 중 하나가 탄소 원자에서 전자를 당기려고 시도하더라도 다른 산소 원자가 동등한 힘으로 탄소의 전자를 당깁니다. 이들 힘은 서로 무효화되며 결과는 두 산소 원자가 전자를 당기고 있지만 분자의 전자는 실제로 위치를 전혀 움직이지 않는다. 이것은 지나치게 음성이거나 양성이되는 분자 영역이 없으며 결과적으로 분자는 비극성입니다.







