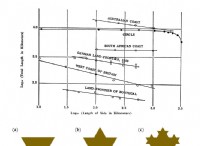
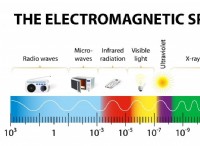
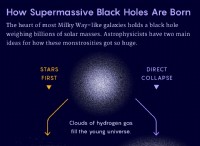
$$ ln [a] _t =-kt + ln [a] _0 $$
어디:
* $ [a] _t $는 시간 t에서 반응물 A의 농도입니다.
* $ k $는 속도 상수입니다
* $ [a] _0 $는 반응물의 초기 농도입니다.
우리는 반응의 연속 반감기가 10 분 및 40 분이라고 주어진다. 1 차 반응의 반감기는 다음과 같습니다.
$$ t_ {1/2} =\ frac {ln2} {k} $$
어디:
* $ t_ {1/2} $는 반응의 반감기입니다
* $ k $는 속도 상수입니다
주어진 반감기를 사용하여 속도 상수를 계산할 수 있습니다.
$$ k =\ frac {ln2} {t_ {1/2}} $$
$$ k =\ frac {ln2} {40 \ min} =1.15 \ times 10^{-2} min^{-1} $$
우리는 또한 반응물 A의 초기 농도가 0.10 M이라는 것을 주어받습니다. 우리는이 정보를 사용하여 언제든지 A의 농도를 계산할 수 있습니다.
$$ ln [a] _t =-kt + ln [a] _0 $$
$$ ln [a] _t =-1.15 \ times 10^{-2} min^{-1} \ times t + ln (0.10 m) $$
$$ [a] _t =e^{-1.15 \ times 10^{-2} min^{-1} \ times t + ln (0.10 m)} $$
이것은 제품에 대한 반응을위한 통합 요율입니다.