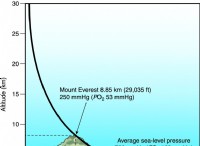
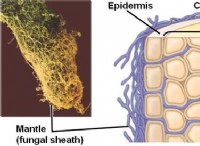
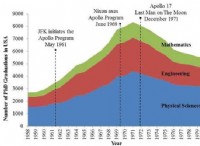
* 유도 쌍극자 : 분산 력은 분자 내의 전자의 움직임으로 인해 발생하는 일시적으로 변동하는 쌍극자로부터 발생합니다. 이 임시 쌍극자는 이웃 분자에서 쌍극자를 유도 할 수 있습니다.
* 더 큰 전자 구름 : 전자가 더 많은 분자는 더 큰 전자 구름을 가지고 있습니다. 이는 일시적으로 고르지 않은 전자 분포 확률이 더 높아서 순간적으로 쌍극자가 더 강하다는 것을 의미합니다.
* 분극성 : 전자 구름을 왜곡 할 수있는 용이성을 분극성이라고합니다. 더 많은 전자를 가진 더 큰 분자는 일반적으로 분극성이 더 높습니다. 이것은 전자 구름이 더 쉽게 왜곡되어 더 강력한 임시 쌍극자를 만듭니다.
요약 :
* 더 많은 전자 =더 강한 분산 력 : 더 많은 전자를 갖는 더 큰 분자는 더 크고 분극 가능한 전자 구름으로 인해 더 강한 분산 력을 경험하여 임시 쌍극자가 더 강해집니다.
예 :
* 알칸 : Alkane 시리즈 (메탄, 에탄, 프로판 등)를 내려 가면 전자의 수가 증가합니다. 이로 인해 더 강한 분산 력과 더 높은 끓는점이 발생합니다.
* 브롬 대 염소 : 브롬은 염소보다 더 많은 전자를 가지고 있습니다. 결과적으로, 브롬은 더 강한 분산 력과 더 높은 끓는점을 갖는다.
중요한 참고 : 분산 력은 모든 분자에 존재하지만 일반적으로 쌍극자 쌍극자 힘 및 수소 결합보다 약합니다. 그러나, 더 큰 분자에서, 분산 력은 지배적 인 분자간 힘이 될 수있다.