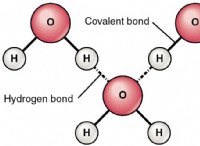
물의 칼슘 이온과 중탄산염 이온은 처음에는 물을 단단하게 보이게 만듭니다. 이것은 이들 이온이 용해 될 때 발생합니다. 칼슘과 마그네슘 양이온이 형성되고 칼슘과 마그네슘 음이온이 형성됩니다. 물을 단단하게 만드는 금속 양이온 때문입니다. 끓거나 석회 (수산화 칼슘)와 같은 경도를 제거하는 방법이 있습니다. 중탄산염은 탄산염을 만들기 위해 특정 온도로 가열되어야합니다. 이로 인해 탄산 칼슘이 용액에서 나오게되면서 식히면 연수가 더 부드러워집니다. 원래 불용성 탄산염은 다른 것들과 혼합 할 수있는 것으로 바뀝니다. 물의 경도를 제거하는 방법 (임시)에 대해 자세히 알아 보겠습니다.
물에서 일시적인 경도를 제거하십시오
1) 끓는 (물리적 방법)
이 경우, 끓는 것은 칼슘과 마그네슘 수소를 (탄산염)와 물과 CO2 가스로 분해하여 탄산염이됩니다. 탄산염은 칼슘과 마그네슘 이온이 물에서 제거 된 다음 보일러 바닥에 고체로 증착 될 때 형성됩니다.
Ca (HCO3) 2 (aq) → CACO3 (S) + CO2 (g) + H2O (L)
2) 수산화 칼슘 (라임 워터) 를 첨가하십시오
물과 혼합 될 수있는 가용성 마그네슘 또는 수소 탄산염이 있습니다. 수산화 칼슘은 그들과 반응하여 가용성이없는 마그네슘 또는 탄산 칼슘을 만듭니다.
Ca (HCO3) 2 (aq) + Ca (OH) 2 (aq) → 2CACO3 (S) + 2H2O (L)
3) 세척 소다를 추가하여 물에서 칼슘 또는 마그네슘 이온을 제거하십시오.
c 𝑎 ()3) 2 (𝑎𝑞 𝑎𝑞) + 𝑁𝑎2𝐶𝑂3 (𝑎𝑞) → 2 𝑁𝑎𝐻𝐶𝑂3 (𝑎𝑞 𝑎𝑞) + 𝐶𝑎𝐶𝑂3 (𝑠 𝑠)
4) 암모니아 물이 첨가된다
수소 탄산염에는 물이 분해 될 수없는 탄산염으로 용해 될 수 있습니다. 이 방법으로 마그네슘과 칼슘 이온이 물에서 나옵니다.
2NH4OH (AQ) + Mg (HCO3) 2 (AQ) → MGCO3 (S) + (NH4) 2CO3 (AQ) + H2O (L)
경도를 제거하는 방법의 화학 :
칼슘과 마그네슘이 탄산 칼슘과 수산화 마그네슘 형태로 물에서 꺼내면 물이 덜 산성화됩니다. CO2 농도와 pH는이 두 고체가 어떻게 결합되는지에 중요한 역할을합니다. 수산화물이 첨가되고 pH가 10 이상으로 상승하면 탄산염 경도를 제거하는 데 도움이 될 수 있습니다.
물의 pH가 10을 초과 할 때 중탄산염 이온은 탄산염 이온으로 변경 될 수 있습니다. 탄산 칼슘 형성보다 공기 중에 탄산염이 훨씬 많습니다. PH를 변경하여 제거 할 수없는 물에는 여전히 많은 칼슘이 있습니다. 이를 비 카보네이트 경도라고합니다.
따라서 칼슘을 여전히 침전시키기 위해 신체 외부에 소다 재 (탄산나트륨)를 넣어야합니다. 수산화 마그네슘은 마그네슘과 물이 혼합 될 때 형성되기 때문에 마그네슘이 제거됩니다. 라임을 라임-소다 애쉬 프로세스에 첨가하여 pH 수준을 높입니다.
5) 탄산염 이온을 얻으려면 탄산나트륨을 넣습니다.
H2CO3 + Ca (OH) 2 → CACO3 + 2H2O
추론 :
- CO2 카본 산과 석회가 혼합 될 때, (1)은이를 중화시키는 과정입니다. 이 방정식은 물의 경도를 변화시키지 않으므로 순 변화는 없습니다. 많은 탄산은 또한 많은 석회로 중화되어야하며, 이는 CACO3의 형태로되어야합니다. 확률 적 비율도 도움이 될 수 있습니다.
- 식 (2)는 물에서 탄산 칼슘 경도를 제거 할 수있는 방법을 보여줍니다. 또한 중탄산 칼슘의 모든 분자는 물의 pH를 높이서 2 개의 탄산염 이온을 형성 할 수 있음을 보여준다. 이 화학량 론적 비율은 또한 중탄산 칼슘의 모든 mg/L에 대해 CACO3의 형태로 1 mg/L의 석회가 필요하다는 것을 보여줍니다. .
- 칼슘 및 비 카보네이트 경도는 방정식에서 제거됩니다. (3), 이것은 경도가 적다는 것을 의미합니다. CACO3는 물에서 제거하기 위해 모든 mg/L의 칼슘 비 탄산염 경도에 사용해야합니다.
- Eq. 4, 말한다 :물에있는 각 마그네슘 중탄산염 경도를 제거하려면 CACO3 또는 석회 형태로 2mg/L의 석회가 필요합니다.
- eq. (5)는 자르면 마그네슘 비 카보네이트 경도가 얼마나 많이 손실되는지를 보여줍니다. 마그네슘 비 탄산염 경도를 제거하려면 경도가 물에있는 Mg/L마다 1mg/L의 석회 또는 CACO3가 필요합니다. 교환이 있습니다 :마그네슘 이온이 꺼지고, 각 마그네슘에 대해 칼슘 이온이 첨가됩니다. 이것은 경도 수준이 바뀌지 않았다는 것을 의미합니다.
결론
물이 단단하기 위해서는 많은 다중 양이온이 있어야합니다. 그들은 하나 이상의 전하가 있기 때문에 "다중"양이온이라고합니다. 그런 다음 하나 이상의 전하 +1로 금속 복합체로 구성됩니다. 대부분의 경우 양이온은 +2입니다. 경수의 양이온은 대부분 CA2+ 및 MG2+입니다. 이 이온은 대수층의 미네랄을 분해하여 수원으로 들어갑니다. 방해석 및 석고와 같은 칼슘이 풍부한 미네랄이 널리 퍼져 있습니다. 전 세계적으로 발견되는 백운석이라 불리는 일반적인 마그네슘 광물이 있습니다 (칼슘이 포함되어 있음). 빗물이나 물에는 증류 된 물에 이온이 많지 않으므로 부드럽습니다.
물에 용해 된 중탄산염 미네랄이 물에 힘들어서“일시적으로 단단해”(중탄산 칼슘과 중탄산 마그네슘)가 있습니다. 물을 단단하게 만드는 금속 양이온 때문입니다. 반면, 황산염 및 염화물 화합물로 인한 경도는 오랫동안 지속되며 끓는 물로 제거 할 수 없습니다. 이 기사는 물의 경도를 제거하는 방법 (임시)을 다루었습니다.