주요 차이 - 헤모글로빈 대 미오글로빈
헤모글로빈과 미오글로빈은 산소 결합 단백질로서 작용하는 글로빈 단백질의 두 가지 유형입니다. 두 단백질 모두 척추 동물의 생물학적 유체 및 일부 무척추 동물에서 용존 산소의 양을 증가시킬 수 있습니다. 유사한 특성을 가진 유기 보철 그룹은 두 단백질 모두에서 산소의 결합에 관여합니다. 그러나, 헤모글로빈과 미오글로빈의 공간 또는 입체 소성기의 3-D 방향은 다르다. 이러한 차이로 인해, 각 단백질 분자에 결합 할 수있는 산소의 양도 다릅니다. 헤모글로빈은 산소와 단단히 결합 할 수 있습니다 미오글로빈은 산소와 단단히 결합 할 수 없습니다. 헤모글로빈과 미오글로빈 사이의 이러한 차이는 다른 기능을 일으킨다. 헤모글로빈은 혈류에서 발견되어 폐에서 나머지 신체로 산소를 운반합니다 myoglobin은 근육에서 발견되지만 산소를 방출해야합니다.
주요 영역을 다루었습니다
1. 헤모글로빈이란 무엇입니까
- 정의, 구조 및 구성, 기능
2. myoglobin
- 정의, 구조 및 구성, 기능
3. 헤모글로빈과 미오글로빈의 유사성
- 유사성을 간략하게 설명합니다
4. 헤모글로빈과 미오글로빈의 차이점은 무엇입니까
- 주요 차이의 비교
주요 용어 :헤모글로빈, 미오글로빈, 산소, 혈증, 단백질, 글로빈 단백질, 혈액
헤모글로빈
헤모글로빈은 4 차 구조를 가진 다중 서브 유닛 구형 단백질입니다. 그것은 사면체 구조에 배열 된 2 개의 α 및 2 개의 β 서브 유닛으로 구성된다. 헤모글로빈은 철-함유 메탈 로프 로프라스입니다. 4 개의 구형 단백질 서브 유닛 각각은 하나의 산소 분자와 결합하는 비 단백질, 보철 혈증 그룹과 관련이있다. 헤모글로빈의 생산은 골수에서 발생합니다. 글로빈 단백질은 시토 졸의 리보조 물에 의해 합성된다. Haem 부분은 미토콘드리아에서 합성됩니다. 전하 철 원자는 동일한 평면에서 4 개의 질소 원자와 철의 공유 결합에 의해 포르피린 고리에 고정된다. 이들 N 원자는 4 개의 글로빈 서브 유닛 각각의 F8 히스티딘 잔기의 이미 다졸 고리에 속한다. 헤모글로빈에서 철은 Fe로 존재하여 적혈구를 적혈구에 제공합니다.
인간은 헤모글로빈 A, 헤모글로빈 A 2 세 가지 헤모글로빈 유형을 가지고 있습니다. 및 헤모글로빈 F. 헤모글로빈 A hba1 에 의해 암호화 된 일반적인 유형의 헤모글로빈입니다. , hba2 및 HBB 유전자. 헤모글로빈 A의 4 개의 서브 유닛은 2 개의 α 및 2 개의 β 서브 유닛 (α <서브> 2 로 구성됩니다. β 2 ). 헤모글로빈 A 2 및 헤모글로빈 F 드문 일이며 각각 2 개의 α 및 2 개의 Δ 서브 유닛 및 2 개의 α 및 2 개의 γ 서브 유닛으로 구성됩니다. 영아에서 헤모글로빈 유형은 HB F (α 2 입니다 γ
헤모글로빈 분자는 4 개의 서브 유닛으로 구성되므로 4 개의 산소 분자와 결합 할 수 있습니다. 따라서, 헤모글로빈은 혈액의 산소 담체로 적혈구에서 발견된다. 구조에 4 개의 서브 유닛의 존재로 인해, 첫 번째 산소 분자가 제 1 혈액 그룹에 결합함에 따라 산소의 결합이 증가한다. 이 과정은 산소의 협력적인 결합으로 확인됩니다. 헤모글로빈은 적혈구의 건조 중량의 96%를 구성합니다. 이산화탄소의 일부는 또한 조직에서 폐로의 수송을 위해 헤모글로빈에 결합됩니다. 이산화탄소의 80%가 혈장을 통해 수송됩니다. 헤모글로빈의 구조는도 1 에 도시되어있다 .
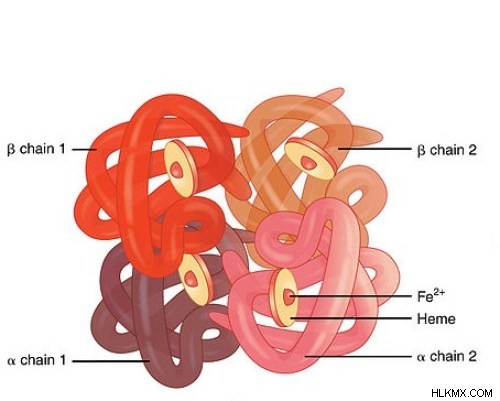
그림 1 :헤모글로빈 구조
헤모글로빈의 기능
myoglobin
myoglobin은 척추 동물의 근육 세포의 산소 결합 단백질로 근육에 별개의 빨간색 또는 진한 회색을 제공합니다. 골격근과 심장 근육에서만 독점적으로 발현됩니다. 미오글로빈은 근육 세포에서 5-10%의 세포질 단백질을 구성합니다. 헤모글로빈 및 미오글로빈의 폴리 뉴클레오티드 사슬의 아미노산 변화가 보수적이기 때문에, 헤모글로빈과 미오글로빈은 모두 유사한 구조를 가지고있다. 또한, 미오글로빈은 단일 혈관 그룹으로 구성된 단일 폴리 뉴클레오티드 사슬을 구성하는 단량체이다. 따라서, 단일 산소 분자와 결합 할 수있다. 따라서, 미오글로빈에서 산소의 협력 적 결합은 발생하지 않는다. 그러나, 미오글로빈의 결합 친화도는 헤모글로빈의 것과 비교할 때 높다. 결과적으로, 미오글로빈은 근육에서 산소 저장 단백질 역할을합니다. 미오글로빈은 근육이 기능 할 때 산소를 방출합니다. 헤모글로빈의 3-D 구조는도 2 에 도시되어있다 .
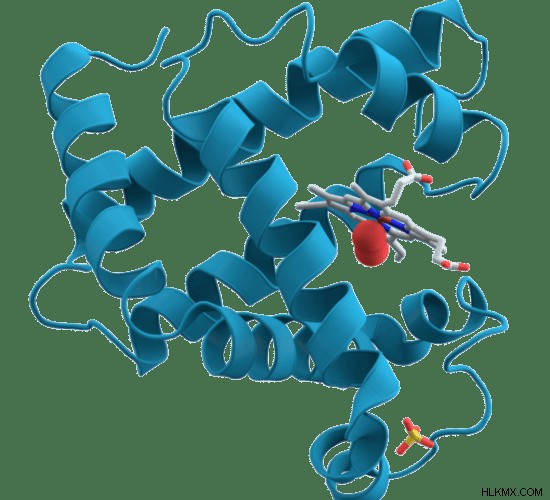
그림 2 :myoglobin
헤모글로빈과 미오글로빈의 유사성
- 헤모글로빈과 미오글로빈 모두 산소 결합 구형 단백질입니다.
- 둘 다 보철 그룹으로 산소 결합 혈액을 포함합니다.
- 헤모글로빈과 미오글로빈은 각각 혈액과 근육에 붉은 색을줍니다.
헤모글로빈과 미오글로빈의 차이
정의
헤모글로빈 : 헤모글로빈은 척추 동물의 혈액에서 산소를 운반하는 데 도움이되는 적색 단백질입니다.
myoglobin : myoglobin은 근육 세포에 산소를 운반하고 저장하는 haem을 가진 적색 단백질입니다.
분자량
헤모글로빈 : 헤모글로빈의 분자량은 64 kDa입니다.
myoglobin : 헤모글로빈의 분자량은 16.7 kDa입니다.
구성
헤모글로빈 : 헤모글로빈은 4 개의 폴리펩티드 사슬로 구성됩니다.
myoglobin : myoglobin은 단일 폴리펩티드 사슬로 구성됩니다.
4 차 구조
헤모글로빈 : 헤모글로빈은 2 개의 α와 2 개의 β 서브 유닛으로 구성된 사량 체입니다.
myoglobin : 미오글로빈은 단량체입니다. 따라서 4 차 구조가 부족합니다.
산소 분자의 수
헤모글로빈 : 헤모글로빈은 4 개의 산소 분자와 결합합니다.
myoglobin : myoglobin은 단일 산소 분자와 만 결합합니다.
협력 결합
헤모글로빈 : 헤모글로빈은 사량 체이기 때문에 산소와 협력적인 결합을 나타냅니다.
myoglobin : myoglobin은 단량체이기 때문에 협력적인 결합을 나타내지 않습니다.
산소에 대한 친화력
헤모글로빈 : 헤모글로빈은 산소와 결합 할 친화도가 낮습니다.
myoglobin : myoglobin은 산소와 산소 농도에 의존하지 않는 산소와 결합하기에 높은 친화력을 가지고 있습니다.
산소와 결합
헤모글로빈 : 헤모글로빈은 산소와 밀접하게 결합 할 수 있습니다.
myoglobin : myoglobin은 산소와 밀접하게 결합 할 수 없습니다.
발생
헤모글로빈 : 헤모글로빈은 혈류에서 발견됩니다.
myoglobin : myoglobin은 근육 내부에서 발견됩니다.
유형
헤모글로빈 : 헤모글로빈 A, 헤모글로빈 A <서브> 2 그리고 헤모글로빈 F는 인간의 헤모글로빈의 유형입니다.
myoglobin : 단일 유형의 미오글로빈은 모든 세포에서 발견됩니다.
기능
헤모글로빈 : 헤모글로빈은 폐에서 산소를 가져 와서 신체의 나머지 부분으로 운반합니다.
myoglobin : 미오글로빈은 근육 세포에 산소를 저장하고 필요할 때 방출됩니다.
결론
헤모글로빈과 미오글로빈은 척추 동물에서 두 개의 산소 결합 구형 단백질입니다. 헤모글로빈은 4 개의 산소 분자와 협력 적으로 결합하는 사량 체입니다. myoglobin은 단일 혈증 그룹으로 구성된 단량체입니다. 헤모글로빈의 결합 능력은 미오글로빈의 결합 능력보다 높기 때문에, 헤모글로빈은 혈액의 산소 전환 단백질로 사용된다. 미오글로빈은 근육 세포에서 산소 저장 단백질로 사용됩니다. 미오글로빈과 산소 결합의 친화력은 헤모글로빈보다 높다. 헤모글로빈과 미오글로빈의 주요 차이점은 기능입니다. 헤모글로빈과 미오글로빈의 기능적 차이는 3D 구조의 차이로 인해 발생합니다.
참조 :
1. " 미오글로빈.” 헤모글로빈과 미오글로빈. N.P., N.D. 편물. 여기에서 사용할 수 있습니다. 2017 년 6 월 5 일.
2.”Myoglobin.” Encyclopædia Britannica. Encyclopædia Britannica, Inc., n.d. 편물. 여기에서 사용할 수 있습니다. 2017 년 6 월 5 일.
이미지 제공 :
OpenStax College의“1904 Hemoglobin” - 해부 및 생리학, Connexions 웹 사이트. 2013 년 6 월 19 일. Commons Wikimedia
2를 통한 (CC x 3.0) → Azatoth의“Myoglobin” - Commons Wikimedia를 통한 PDB 입력 (Public Domain)을 기반으로 자체 제작